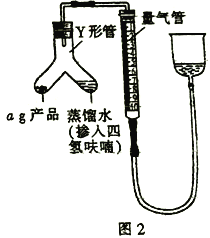
题目内容
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②CO ③CO和H2的混合物 ④HCOOCH3⑤CH3CHO
A.⑤B.①②C.①②③④D.①②③④⑤
【答案】A
【解析】
这些物质完全燃烧后生成二氧化碳或水或二者都有,2H2 +O2![]() 2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2
2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2![]() 2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意。
2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意。
这些物质完全燃烧后生成二氧化碳或水或二者都有,2H2 +O2![]() 2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2
2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2![]() 2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意;
2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意;
①②③符合(CO)m(H2)n;④HCOOCH3化学式改写为(CO)2(H2)2符合(CO)m(H2)n;⑤CH3CHO化学式改写为(CO)(H2)2C,不符合(CO)m(H2)n,故选A。
故选A。

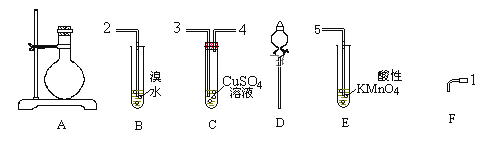
【题目】欲用下图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
制备气体 | X(除杂试剂) | Y (检验试剂) |
| |
A | CH3CH2Br与 NaOH 乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | 电石与 NaCl 水溶液 | H2O | Br2 的CCl4溶液 | |
C | C2H5OH与浓硫酸加热至 170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | 生石灰与浓氨水 | 浓硫酸 | 酚酞溶液 |
A.AB.BC.CD.D