题目内容
【题目】硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入 [Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀, Cu+基态核外电子排布式为 ______ .
②CaC2中![]() 与
与![]() 互为等电子体. 1mol
互为等电子体. 1mol![]() 中含有的π键数目为 ______ .
中含有的π键数目为 ______ .
③乙炔与氢氰酸反应可得丙烯睛(CH2=CHC=N),丙烯腈分子中碳原子轨道杂化类
型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______.
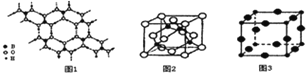
(2)硼酸 (H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1),则1mol H3BO3的晶体中有 ______ mol氢键.硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______
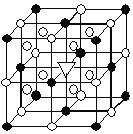
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示![]() 黑点代表铜原子,空心圆代表M原子
黑点代表铜原子,空心圆代表M原子![]() .
.
![]() 该晶体化学式为 ______ .
该晶体化学式为 ______ .
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ ![]() 填“离子”、“共价”
填“离子”、“共价”![]() 化合物.
化合物.
(4)Cu3N的晶胞结构如右上图3, N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______ g·cm-3。(阿伏加德罗常数用![]() 表示)
表示)
【答案】1s22s22p63s23p63d10 2NA sp、sp2 N 3 正四面体型 CuCl 共价 ![]()
![]() 。
。
【解析】
根据基态离子核外电子排布规律写出离子的基态电子排布式;根据等电子原理判断离子结构;根据价层电子对互斥理论判断空间构型;根据电离能规律判断电离能大小;根据均摊法计算晶胞中粒子个数及晶胞密度。
(1)①Cu为29号元素,3d轨道有10个电子,4s轨道有1个电子,Cu原子失去最外层电子形成Cu+,Cu+的基态电子排布式为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
②等电子体的结构相似,则![]() 中含有三键,所以在1个
中含有三键,所以在1个![]() 含有2个π键,故1mol
含有2个π键,故1mol![]() 中,含有2NA个π键,故答案为:2NA;
中,含有2NA个π键,故答案为:2NA;
③丙烯腈(CH2=CHC=N)中的C分别形成2个σ键和3个σ键,故碳原子的杂化轨道类型为sp和sp2杂化;越易失去一个电子,则第一电离能越大,CH2=CHC=N中N元素最难失去电子,则N的第一电离能最大,故答案为:sp、sp2;N;
(2)一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1mol H3BO3分子的晶体中有3mol氢键,[B(OH)4]-中B原子形成4个共价键,则B原子的价层电子对数为4,为sp3杂化,没有孤电子对,空间结构为正四面体型,故答案为:3;正四面体型;
(3)M原子的外围电子排布式为3s23p5,M原子为Cl原子,则
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子位于顶点与面心上,晶胞中含有Cl原子数目为![]() ,故化学式为CuCl,故答案为:CuCl;
,故化学式为CuCl,故答案为:CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与X的电负性分别为1.9和3.0,差值为1.1小于1.7,形成共价键,故答案为:共价;
(4)该晶胞中大球个数![]() ,小球个数
,小球个数![]() ,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长
,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长![]() ,晶胞体积
,晶胞体积![]() ,晶胞密度
,晶胞密度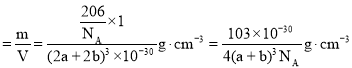 ,故答案为:6;
,故答案为:6;![]() 。
。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
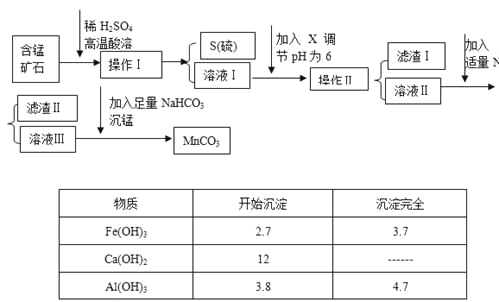
回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。