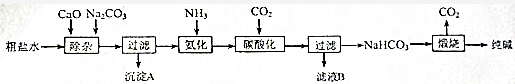
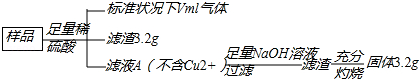题目内容
4.298K时,将x mL pH=a的稀盐酸溶液与y mL pH=b稀NaOH充分反应.下列关于反应后溶液pH的判断,正确的是( )| A. | 若x=y,且a+b=14,则pH>7 | B. | 若10x=y,且a+b=13,则pH=7 | ||
| C. | 若ax=by,且a+b=13,则pH=7 | D. | 若10x=y,且a+b=14,则pH>7 |
分析 pH=b的稀NaOH溶液中c(OH-)=10b-14mol/L,pH=a的稀盐酸中c(H+)=10-amol/L,有$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$,若二者恰好中和,应存在10b-14x=10-ay,pH=7,若10b-14x>10-ay,碱过量,溶液pH>7,否则小于7,以此解答该题.
解答 解:pH=b的稀NaOH溶液中c(OH-)=10b-14mol/L,pH=a的稀盐酸中c(H+)=10-amol/L,则:
A.若x=y,且a+b=14,则有:$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-14=1,即n(H+)=n(OH-),酸碱恰好中和,溶液呈中性,pH=7,故A错误;
B.若10x=y,且a+b=13,则有$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-13=1,即n(H+)=n(OH-),pH=7,故B正确;
C.若ax=by,且a+b=13,则有$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-14×$\frac{y}{x}$=$\frac{y}{10x}$,由于不知x、y的大小,则无法判断溶液的pH,故C错误;
D.若10x=y,且a+b=14,则有$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-13=10,则碱过量,pH>7,故D正确;
故选BD.
点评 本题考查酸碱混合的计算和判断,题目难度中等,注意根据体积和pH的关系确定酸碱溶液中$\frac{n(O{H}^{-})}{n({H}^{+})}$的值,以此确定反应的程度,试题培养了学生的分析能力及灵活应用能力.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 1molNa2O2晶体中阴离子的个数为2NA | |
| B. | 1 mol•Lˉ1FeCl3溶液含有的Cl-数为3 NA | |
| C. | 标准状况下,2.24L苯所含的分子数为0.1NA | |
| D. | 32g O2和32g O3 所含的氧原子数都是为2NA |
| A. | (NH4)2CO3在室温下就能自发地分解产生氨气是因为生成了易挥发的气体,使体系的熵增大 | |
| B. | 低温更有利于2NO(g)+O2(g)═2NO2(g)的自发进行 | |
| C. | 由于2Na+2H2O=2NaOH+H2↑反应在常温下能自发进行,故该反应一定是放热反应 | |
| D. | 常温下,CO2(g)+C(s)═2CO(g)不能自发进行,则该反应的△H>0 |
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| C. | 1000mL0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 质量为32g的O3和O2的混合物中含有的氧原子数为NA |
| A. | 2A3++2B-═2A2++B2 | B. | C2+2B-═2C-+B2 | ||
| C. | 2A2++C2═2A3++2C- | D. | B2+2C-═C2+2B- |