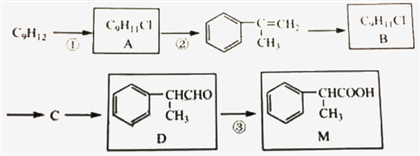
题目内容
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表中第____族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)6](NO3)2的名称是三硝酸六尿家合铁(Ⅲ),是一种重要的配合物。该化合物中Fe2+的核外电子排布式为_____,尿素分子中C、N原子的杂化方式分别是____、____,其分子中σ键与π键的数目之比为____,所含非金属元素的电负性由大到小的顺序是____.
(3)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是________。
(4)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀.则第二种配合物的配体为____。
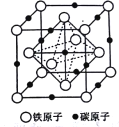
(5)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图所示,则该物质的化学式为______,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为___pm (阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
【答案】 Ⅷ 3 [Ar]3d5(或1s22s22p63s23p63d5) sp2 sp3 7∶1 O、N、C、H 离子半径大小 SO42-、NH3 FeC ![]()
【解析】(1)钴的原子序数是27,位于元素周期表中第Ⅷ族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2,未成对电子的个数为3。(2)铁的原子序数是26,Fe2+的核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5);尿素的结构简式为HN2-CO-NH2,碳原子存在双键,氮原子全部是单键,且存在孤对电子,所以分子中C、N原子的杂化方式分别是sp2、sp3。单键都是σ键,双键中含有1个σ键和1个π键,则其分子中σ键与π键的数目之比为7:1。非金属性越强电负性越大,则所含非金属元素的电负性由大到小的顺序是O、N、C、H;(3)晶格能与离子半径和离子所带电荷数有关系,因此比较FeO与NaCl的晶格能大小,还需要知道的数据是离子半径大小。(4)在第一种配合物溶液中加硝酸银溶液产生白色沉淀,白色沉淀是硫酸银,说明硫酸根不是配体。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,沉淀是溴化银,说明溴离子不是配体,则第二种配合物的配体为SO42-、NH3。(5)根据晶胞结构可知铁原子个数是8×1/8+6×1/2=4,碳原子个数12×1/4+1=4,因此该物质的化学式为FeC;晶胞中最近的两个碳原子的距离为面对角线的一半,晶胞的边长=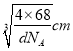 ,面对角线是
,面对角线是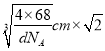 ,所以晶胞中最近的两个碳原子的距离为
,所以晶胞中最近的两个碳原子的距离为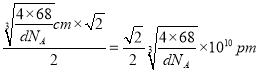 。
。

【题目】下列说法正确的是
A. 蛋白质溶液中加入Na2SO4可使其变性
B. 蔗糖水解生成互为闻分异构体的葡萄糖和果糖
C. 顺—2一丁烯和反—2—丁烯的加氢产物不同
D. 石油的分馏和煤的于馏均属于化学变化
【题目】下列项目判断,结论正确的是
选项 | 项目 | 结论 |
A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
A. A B. B C. C D. D