题目内容
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”);
②某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 . a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是 .
A.2c1>c3
B.a+b<90.8
C.2p2<p3
D.α1+α3<1.
【答案】
(1)CD
(2)<;80%;250℃
(3)df
(4)D
【解析】解:(1)A.生成CH3OH的速率与消耗CO的速率均表示正反应速率,反应始终按该比例关系进行,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体的始终密度不变,故B错误;
C.混合气体总质量不变,随反应进行混合气体总物质的量减小,平均相对分子质量减小,混合气体的相对平均分子质量不变,说明到达平衡,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,说明到达平衡,故D正确,
故选:CD;(2)①由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,即△H1<0,所以答案是:<;
②充分反应达到平衡后,测得c(CO)=0.2mol/L,其物质的量为2L×0.2mol/L=0.4mol,则:
CO (g)+ | 2H2 (g) | CH3OH (g) | |
起始(mol) | 2 | 6 | 0 |
转化(mol) | 1.6 | 3.2 | 1.6 |
平衡(mol) | 0.4 | 2.8 | 1.6 |
CO的转化率= ![]() ×100%=80%,
×100%=80%,
此时的平衡常数K= ![]() =
= 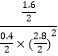 ≈2.041,所以温度为250℃,
≈2.041,所以温度为250℃,
所以答案是:80%;250℃;(3)a.正反应为放热反应,升温平衡逆向移动,CO转化率减小,故a错误;
b.加入催化剂加快反应速率,但不影响平衡移动,CO转化率不变,故b错误;
c.增加CO的浓度,CO转化率减小,故c错误;
d.加入H2加压,平衡正向移动,CO转化率增大,故d正确;
e.加入惰性气体加压,恒温恒容下平衡不移动,CO转化率不变,故e错误;
f.分离出甲醇,平衡正向移动,CO转化率增大,故f正确,
故选:df;(4)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B.由题目可知生成1molCH3OH的能量变化为 ![]() =90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1﹣n),故a+b=90.8,故B错误;
=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1﹣n),故a+b=90.8,故B错误;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
所以答案是:D.
【考点精析】利用化学平衡状态本质及特征和化学平衡状态的判断对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案