题目内容
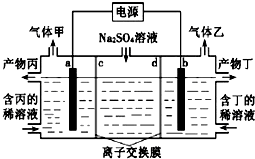
【题目】如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL,回答下列问题:

(1)电源F是__________极;
(2)A池的第②极上的电极反应式_________
(3)通电前A池中原混合溶液Cu2+的浓度________
【答案】 正 4OH--4e-===2H2O +O2↑ 0.025 mol·L-1
【解析】分析:通电5min后,第③极增重,所以第③极是阴极,则F是电源正极,第②极是阳极;根据阴阳极上转移电子守恒计算硫酸铜的物质的量浓度。
详解:(1)通电5min后,第③极增重,所以第③极是阴极,则F是电源正极,第②极是阳极;
(2)第②极是阳极,A中阳极上氢氧根离子放电生成氧气,其电极反应式为:4OH--4e-=2H2O+O2↑;
(3)第③极反应为Ag++e-=Ag,n(Ag)=2.16g÷108g/mol=0.02mol,则转移的电子为0.02mol。A池中阳极反应为4OH--4e-=2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL<224mL,所以在阴极上还有氢气生成,体积是112mL,氢气的物质的量为0.005mol,由2H++2e-=H2↑可知转移电子是0.01mol,则铜离子得到的电子是0.02mol-0.01mol=0.01mol,由Cu2++2e-=Cu可知Cu2+的物质的量为0.005mol,因此通电前c(CuSO4)=0.005mol÷0.2L=0.025 molL-1。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”);
②某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 . a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是 .
A.2c1>c3
B.a+b<90.8
C.2p2<p3
D.α1+α3<1.