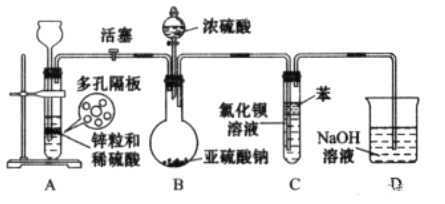
��Ŀ����
����Ŀ���Ȼ���ͭ(CuCl)�㷺Ӧ����ұ��ҵ��Ҳ����������ɱ����������ͭ����Ϊԭ������CuCl�Ĺ������£�
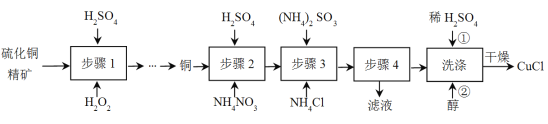
��֪CuCl�����ڴ���ˮ������c(Cl-)�ϴ����ϵ[CuCl(s)+Cl-![]() CuCl2-]����ʪ��������ˮ��������
CuCl2-]����ʪ��������ˮ��������
��1������1��ʼǰ��Ҫ����ͭ������з��飬Ŀ����______��
��2������1��������������Ĺ��̣��ù���������ɫ��Һ��dz��ɫ��������ѧ����ʽ��__________________________________��
��3������2���ܽ���̣��ܽ�ʱ��Ӧ�����ӷ���ʽ______��
��4������3Ϊ����Ӧ��Cu+�ij�����������NH4Cl������ϵ��ͼ��ʾ��

�ٷ�Ӧ������������______��
�ڱȽ�c(Cu+)��Դ�С��A��______C�㣨����>������<������=������
�����C��״̬�������Cu+�����ʵĴ�ʩ��______��
��5������4���е�ʵ�������______��
��6��ϴ�ӹ����в�����������������������ϴ����������______��
���𰸡�����Ӵ�������ӿ췴Ӧ���ʡ����ͭ�Ľ������ʵȺ����Դ� CuS+H2SO4+H2O2=CuSO4+S+2H2O 3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��Cu+4H++2NO3-=Cu2++2NO2��+2H2O SO42- ��(NH4)2SO4 > ��ˮϡ�� ���� HNO3����ǿ�����Ի��CuCl����
��������
H2O2�����������½�CuS�е�S2-��������S���ʣ��䷴Ӧ����ʽΪ��CuS+H2SO4+H2O2=CuSO4+S+2H2O��CuSO4����ԭ����Cu���ʣ�����NO3-�����������¾���ǿ�����ԣ�������Cu��������Cu2+��Ȼ����ˣ���Һ�м���(NH4)2SO3��NH4Cl����������ԭ��Ӧ����CuCl�������ӷ�Ӧ����ʽΪ��2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+���õ���CuCl��������ϴ�������Ҵ�ϴ�ӣ���ɵõ�CuCl��
��1�������������ǰ�Ƚ�ͭ������Ŀ��������Ӵ�������ӿ�������ʣ����ͭ�Ľ����ʵȣ��ʴ�Ϊ������Ӵ�������ӿ췴Ӧ���ʡ����ͭ�Ľ������ʵȺ����Դ𰸡�
��2���ù���������ɫ��Һ��dz��ɫ������˵����������ͭ�����ʣ�H2O2�����������½�CuS�е�S2-��������S���ʣ��䷴Ӧ�Ļ�ѧ��Ӧ����ʽΪCuS+H2SO4+H2O2=CuSO4+S+2H2O���ʴ�Ϊ��CuS+H2SO4+H2O2=CuSO4+S+2H2O��
��3�����ܽ��������У�����NO3-�����������¾���ǿ�����ԣ�������Cu��������Cu2+�����ӷ�Ӧ����ʽΪ��3Cu+8H++2NO3-=3Cu2++
2NO��+4H2O��Cu+4H++2NO3-=Cu2++2NO2��+2H2O ���ʴ�Ϊ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��Cu+4H++2NO3-=Cu2++2NO2��+2H2O ��
��4�����漰��ӦΪ��2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+����Ӧ��SԪ�ػ��ϼ���+4������Ϊ+6�ۣ�����������������ΪSO42-��(NH4)2SO4���ʴ�Ϊ��SO42- ��(NH4)2SO4��
��B��֮ǰCu+��Cl-�γ�CuCl�ij�����B��ʱ������CuCl(s)![]() Cu+(aq)+Cl-(aq)��B��֮��c(Cl-)������CuCl(s)�ܽ⣬[CuCl(s)+Cl-
Cu+(aq)+Cl-(aq)��B��֮��c(Cl-)������CuCl(s)�ܽ⣬[CuCl(s)+Cl-![]() CuCl2-]������ƽ��û�ƶ�������C���B���c(Cu+)��ȣ�����B��֮ǰ��CuCl(s)
CuCl2-]������ƽ��û�ƶ�������C���B���c(Cu+)��ȣ�����B��֮ǰ��CuCl(s)![]() Cu+(aq)+Cl-(aq)ƽ�������ƶ�������A��c(Cu+)����B�㣬��A��c(Cu+)����C�㣬�ʴ�Ϊ��>��
Cu+(aq)+Cl-(aq)ƽ�������ƶ�������A��c(Cu+)����B�㣬��A��c(Cu+)����C�㣬�ʴ�Ϊ��>��
��B��֮��c(Cl-)������CuCl(s)�ܽ⣬����[CuCl(s)+Cl-![]() CuCl2-]���������٣��������C��״̬�������Cu+�����ʣ����Լ�ˮϡ�ͣ�����c(Cl-)���ʴ�Ϊ����ˮϡ�͡�
CuCl2-]���������٣��������C��״̬�������Cu+�����ʣ����Լ�ˮϡ�ͣ�����c(Cl-)���ʴ�Ϊ����ˮϡ�͡�
��5������4�ǹ�Һ���룬���Խ��е�ʵ������ǹ��ˣ��ʴ�Ϊ�����ˡ�
��6���������ǿ�����ԣ�������CuCl������������������ᣬ�ʴ�Ϊ��HNO3����ǿ�����Ի��CuCl������

����Ŀ�����ڿ���������������Ҫ���ã�ij��ȤС����0.50molL-1 KI��0.2%������Һ��0.20molL-1 K2S2O8��0.10molL-1 Na2S2O3���Լ���̽����Ӧ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��֪��S2O82-+2I-=2SO42-+I2������ I2+2S2O32-=2I-+S4O62-���죩
��1����KI��Na2S2O3����۵Ļ����Һ�м���һ������K2S2O8��Һ������Һ�е��� ���ľ�����Һ��ɫ������ɫ��Ϊ��ɫ��Ϊȷ���ܹ۲쵽��ɫ��S2O32-��S2O82-��ʼ�����ʵ���������Ĺ�ϵΪ��n(S2O32-)��n(S2O82-)�� ����
��2��Ϊ̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���
ʵ�� | ���V/mL | ||||
K2S2O8��Һ | ˮ | KI��Һ | Na2S2O3��Һ | ������Һ | |
�� | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
�� | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
�� | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
����Vx=�� ��mL���������� ����
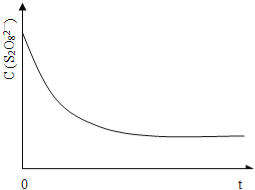
��3����֪ij�����£�Ũ��c(S2O82-)����Ӧʱ��t�ı仯������ͼ13�������������������䣬���ڴ������ͼ�У��ֱ����ͷ�Ӧ�¶Ⱥͼ������ʱc(S2O82-)����Ӧʱ��t�ı仯����ʾ��ͼ��������Ӧ�ı�ע����
��4����Ҳ����������������Դ��﮵��صIJ��ϣ��õ�ط�ӦΪ��2Li(s)+I2(s)=2LiI(s) ��H
��֪��4Li(s)+O2(g)=2Li2O(s) ��H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) ��H2
���ط�Ӧ����H= ����缫��Ϊ�õ�ص��� ������