题目内容
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216.4kJ/mol
b.CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=_____________kJ/mol
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如图。
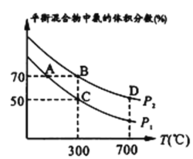
①恒压时,反应一定达到平衡状态的标志是__________ (填序号);
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 比值保持不变
比值保持不变
D.![]() =2
=2
②P1________P2(填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点______D点;
③C点H2的转化率_______________;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A)_______v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式_____________________________________________。
②当转移电子量为0.3NA时,标况下消耗NH3____________L。
【答案】+175.2kJ/mol BC < > 66.7%(或2/3) < 2NH3+NaClO![]() N2H4+NaCl+H2O 6.72L
N2H4+NaCl+H2O 6.72L
【解析】
(1)将两个热化学方程式叠加,就可得到相应反应的热化学方程式,△H也相加;
(2)①根据反应达到平衡时任何一组分的速率不变,物质的浓度、含量等不变判断平衡状态;
②该反应是气体体积减小的反应,在温度不变时,增大压强,平衡正向移动,氨的含量增加;在压强不变时,根据该反应的正反应是放热反应分析判断B、D两点的化学平衡常数大小;
③根据C点时氨的含量是50%,利用三段式计算H2的转化率;根据A、B两点的温度、压强的大小及温度、压强与化学反应速率的影响分析;
(3)利用题目信息找出反应物和生成物,再利用电子守恒及质量守恒配平,然后计算。
(1)a+b,整理可得CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)△H=+175.2kJ/mol,故答案为+175.2kJ/mol;
CO2(g)+4H2(g)△H=+175.2kJ/mol,故答案为+175.2kJ/mol;
(2)①A.N2(g)+3H2(g)![]() 2NH3(g)在该反应中N2、H2反应的物质的量的比是1:3,加入的物质的物质的量的比是1:3,所以无论反应是否达到平衡,N2和H2的转化率都相等,不能据此判断反应为平衡状态,A错误;
2NH3(g)在该反应中N2、H2反应的物质的量的比是1:3,加入的物质的物质的量的比是1:3,所以无论反应是否达到平衡,N2和H2的转化率都相等,不能据此判断反应为平衡状态,A错误;
B.该反应是反应前后气体分子数不相等的反应,由于压强恒定不变,若反应未达到平衡,气体体积就会发生变化,由于气体质量不变,所以密度就会发生变化,因此若密度不变,反应达到平衡状态,B正确;
C.氢气是反应物,氨气是生成物,若氢气减少,则氨气必然增加,其比值就会发生变化,当![]() 的比值不变时说明反应达到平衡状态, C正确;
的比值不变时说明反应达到平衡状态, C正确;
D.氮气是反应物,氨气是生成物,只要不平衡,若氮气减少,则氨气比增加,其比值![]() 就会发生变化,当比值不变时,说明反应处于平衡状态,但当比值为2时,不一定说明不再变化,所以不一定是平衡状态,D错误;
就会发生变化,当比值不变时,说明反应处于平衡状态,但当比值为2时,不一定说明不再变化,所以不一定是平衡状态,D错误;
故合理选项是BC;
②该反应是气体体积减小的反应,在温度不变时,增大压强,平衡向气体体积减小的正反应方向移动,氨的含量增加,由图可知,在温度相同时,压强为P1时的平衡混合物中氨的体积分数小于压强为P2时,所以根据图示可知压强:P2>P1,即P1<P2,故答案为<;
合成氨气的反应是放热反应,在压强不变时,升高温度,化学平衡向吸热的逆反应方向移动,化学平衡常数越小,D点的温度高于B点的温度,所以化学平衡常数:B>D,故答案为>;
③N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
开始(mol) 1 3 0
转化(mol)x 3x 2x
平衡(mol)1-x 3-3x 2x
由于平衡时混合物中氨的体积分数为50%,![]() =50%,解得x=2/3,由于氮气与氢气反应的物质的量的比是1:3,加入的物质的物质的量的比是1:3,所以氮气与氢气的转化率相等,即为66.7%,故答案为66.7%;
=50%,解得x=2/3,由于氮气与氢气反应的物质的量的比是1:3,加入的物质的物质的量的比是1:3,所以氮气与氢气的转化率相等,即为66.7%,故答案为66.7%;
根据图示可知A、B两点平衡混合物中氨的含量相同,B点温度和压强均高于A点温度和压强,温度升高,速率加快,压强增大,速率加快,所以在A、B两点条件下的化学反应速率v(A)<v(B),故答案为<;
(3) N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4,反应中N的化合价升高,故氯的化合价降低,产物为NaCl,在根据得失电子守恒和质量守恒,方程式为2NH3+NaClO N2H4+NaCl+H2O,根据方程,2mol NH3反应生成1mol N2H4转移2NA的电子,当转移电子量为0.3NA时,标况下消耗NH30.3mol,在标况下的体积为V=0.3mol×22.4L/mol=6.72L,故答案为2NH3+NaClO
N2H4+NaCl+H2O,根据方程,2mol NH3反应生成1mol N2H4转移2NA的电子,当转移电子量为0.3NA时,标况下消耗NH30.3mol,在标况下的体积为V=0.3mol×22.4L/mol=6.72L,故答案为2NH3+NaClO N2H4+NaCl+H2O;6.72L。
N2H4+NaCl+H2O;6.72L。