题目内容
下列离子中,与Na+含有相同电子数的是
| A.F- | B.Cl- | C.Br- | D.I- |
A
试题分析:中性原子中质子数=核外电子数,阳离子核外电子数=质子数-电荷守恒,阴离子核外电子数=质子数+电荷数,所以Na+含有的电子数=11-1=10,A中核外电子数=9+1=10,B中核外电子数=17+1=18,C中核外电子数=35+1=36,D中核外电子数=53+1=54,答案选A。
点评:该题是基础性试题的考查,难度不大。明确核外电子数的计算依据是答题的关键,注意分清楚原子、阴离子、阳离子的计算方法的不同。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目


 位于大立方体顶点和面心,
位于大立方体顶点和面心,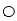 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)