题目内容
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
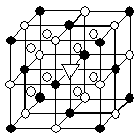
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示,
 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
(1)三 ⅣA 大 (2)小 分子间作用力 甲醛
(3)先产生白色沉淀,后沉淀溶解 Si+4HF=SiF4↑+2H2↑
(4)2Al(s)+3O2(g)=Al2O3(s);△H=-1676kJ/mol (5)①Na2CO3 离子晶体 ②AlF6-
(3)先产生白色沉淀,后沉淀溶解 Si+4HF=SiF4↑+2H2↑
(4)2Al(s)+3O2(g)=Al2O3(s);△H=-1676kJ/mol (5)①Na2CO3 离子晶体 ②AlF6-
试题分析:Y是地壳中含量最高的元素,则Y是氧元素。X的最高价氧化物对应的水化物化学式为H2XO3,这说明X是第ⅣA族元素。由于X的原子序数小于Y的,则X是碳元素。Z的基态原子最外层电子排布式为3s23p1,所以Z是铝元素。W的一种核素的质量数为28,中子数为14,则质子数=28-14=14,所以W是硅元素。
(1)硅的原子序数是14,W位于元素周期表第三周期第ⅣA族;同主族自上而下原子半径逐渐增大,则W的原子半径比X的大。
(2)非金属性越强,第一电离能越大,铝是金属,所以Z的第一电离能比W的小;CO2形成的晶体是分子晶体,所以CO2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,其中一种能形成同种分子间氢键的物质名称甲醛。
(3)由于氢氧化铝是两性氢氧化物,所以振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是先产生白色沉淀,后沉淀溶解;硅单质与氢氟酸反应生成两种无色气体,反应的化学方程式是Si+4HF=SiF4↑+2H2↑。
(4)13.5g铝的物质的量是13.5g÷27g/mol=0.5mol,则2mol铝反应放出的热量是419kJ×4=1676kJ。因此在25°、101kpa下,该反应的热化学方程式是2Al(s)+3O2(g)=Al2O3(s);△H=-1676kJ/mol。
(5)①根据反应的方程式并依据原子守恒可知,A应该是碳酸钠。碳酸钠是离子化合物,属于离子晶体。
②根据晶胞的结构可知,晶胞中含有
 的个数是
的个数是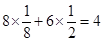 个,含有
个,含有 的个数是
的个数是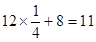 。根据化学式知,Na+和AlF6- 的个数比是3:1,则白色球和黑色球之比接近3:1,要使其为3:1,则▽所代表的应该是AlF6-。
。根据化学式知,Na+和AlF6- 的个数比是3:1,则白色球和黑色球之比接近3:1,要使其为3:1,则▽所代表的应该是AlF6-。点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目

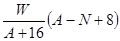 mol
mol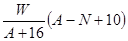 mol
mol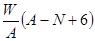 mol
mol