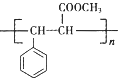
题目内容
【题目】今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)
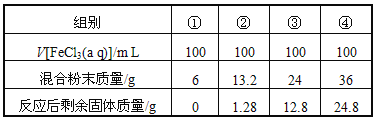
有关说法不正确的是( )
A. 第①组溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体只有铜
C. 第③④组反应后的滤液中c(Fe2+)=6 mol/L
D. 原混合粉末中n(Fe):n(Cu)=11:9
【答案】D
【解析】分析:金属性Fe>Cu,氯化铁首先氧化金属铁,然后再氧化金属铜,结合固体质量的变化、反应的方程式分析解答和计算。
详解:每一组中氯化铁均是0.4mol,从②组数据中可以得出,FeCl3溶液全部参与反应,假设只发生反应为Fe+2Fe3+=3Fe2+,则溶解的Fe的质量为11.2g,13.2-1.28=11.92>11.2,所以同时也有一部分Cu溶解发生反应:Cu+2Fe3+=Fe2++Cu2+,则剩余的固体全部为Cu;利用②的数据,设Fe、Cu合金中金属物质的量分别为xmol、ymol,则
Fe+2Fe3+=3Fe2+
1 2
x 0.2x
Cu+2Fe3+=Cu2++2Fe2+
1 2
0.2-x 0.4-0.2x
依据铜元素守恒(0.2-x)+1.28÷64=y;质量守恒56x+64y=13.2,解得:x=y=0.11,即铜与铁物质的量比是1:1,D错误。
利用③的数据,正好是24-11.2=12.8,所以只发生了Fe+2Fe3+=3Fe2+,剩余的12.8全部为Cu,所以n(Fe):n(Cu)=![]() =1:1,符合铁和铜的物质的量之比,B正确;
=1:1,符合铁和铜的物质的量之比,B正确;
①组,6g固体中含有Cu、Fe的物质的量各为0.05mol
Fe+2Fe3+=3Fe2+
1 2 3
0.05 0.1 0.15
Cu+2Fe3+=Cu2++2Fe2+
1 2 1 2
0.05 0.1 0.05 0.1
c(Fe3+)=![]() =2.0mol/L,A正确;
=2.0mol/L,A正确;
③组中生成亚铁离子是0.6mol,浓度是6.0mol/L;根据③组实验可知④组中只有铁被溶解,剩余的金属是铁和铜混合物,三价铁全部反应,根据铁元素守恒可知,0.4molFe3+全部反应生成0.6molFe2+,所以反应后溶液中亚铁离子的浓度为6mol/L,C正确;答案选D。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
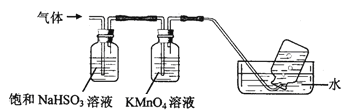
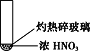
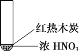
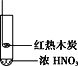
浙江新课程三维目标测评课时特训系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为氧化产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应