题目内容
【题目】W是由A、B两种元素组成的AB2型化合物。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为________________(填化学式)。
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为________________。
②上述实验中,W与足量氯水反应的离子方程式为_________________________________________________________。
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为___________________。
②1mol W与足量水充分反应,转移电子的物质的量为_____________mol。
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。
①B在元素周期表中的位置为______________________________。
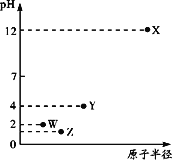
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为______________________;
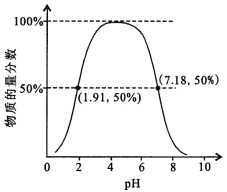
该二元弱酸的一级电离常数为Ka1,则pKa1=—lgKa1≈______________________。
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为_________________。
【答案】SiO2 Fe2+ 3Cl2 + 4I- + 2Fe2+ == 2 I2 + 6Cl- + 2 Fe3+ ![]() 1 第2周期ⅥA族 HSO3- 1.91 H2SeO3 + H2O2 = H2SeO4 + H2O
1 第2周期ⅥA族 HSO3- 1.91 H2SeO3 + H2O2 = H2SeO4 + H2O
【解析】
(1)半导体材料是硅,制备反应是C+SiO2=Si+CO,W为SiO2;
(2)往一支试管中滴入KSCN溶液,无明显现象,说明原溶液中不存在没有铁离子,另一支试管中加入足量氨水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色,说明原溶液中存在碘离子,往上层溶液中滴人KSCN溶液,溶液呈红色,说明原溶液中存在亚铁离子,则w溶液中所含金属阳离子为亚铁离子。在上述实验中加足量氨水,亚铁离子、碘离子被完全氧化,其反应的离子方程式为:3Cl2 + 4I- + 2Fe2+ == 2 I2 + 6Cl- + 2 Fe3+;
(3)AB2型的离子化合物,且阴、阳离子个数比为1∶1,阴、阳离子均含18个电子,若阴离子为B22—,则A为钙,若阴离子为B2—,则阴离子所含电子数不是18。W的化学式为CaO2,阴离子的电子式为:![]() ;1 molCaO2与足量水充分反应,负一价氧发生歧化反应生成氧气和氢氧化钙,转移1mol电子;
;1 molCaO2与足量水充分反应,负一价氧发生歧化反应生成氧气和氢氧化钙,转移1mol电子;
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;
①氧元素处于周期表中第二周期VIA族,故答案为:第二周期VIA族;②如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2,SeO2的水溶液被双氧水氧化的化学方程式为:H2SeO3+H2O2=H2SeO4+H2O;故答案为:H2SeO3 + H2O2=H2SeO4 + H2O。

 名校课堂系列答案
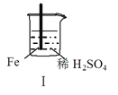
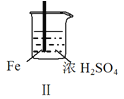
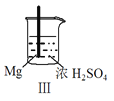
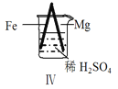
名校课堂系列答案【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强