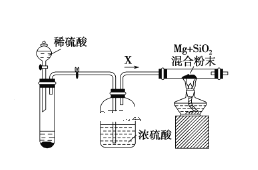
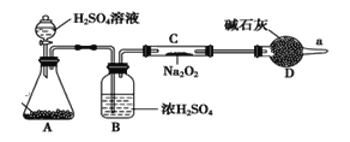
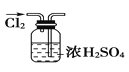
题目内容
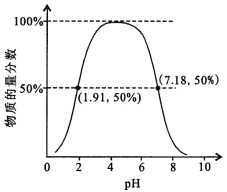
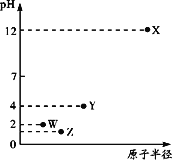
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010 mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
A. 简单离子半径:X>Y>Z>W
B. Y元素存在同素异形体
C. 气态氢化物的稳定性:Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
【答案】B
【解析】
试题同周期元素的原子序数越大,原子半径越小,所以原子序数X>Y>Z>W,X的最高价氧化物的水溶液为碱性,而且0.010 mol·L-1的这四种溶液pH为12,确定为一元强碱,所以X为Na,W的最高价氧化物的水溶液的pH为2,W为Cl、Z为S,Y的溶液的pH为4,为弱酸磷酸,Y为P,存在同素异形体。四种元素简单离子的半径Y>Z>W>X;YZW的非金属性逐渐减弱,所以气态氢化物的稳定性逐渐减弱,D项NaOH与磷酸恰好反应时的溶液为碱性。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目