题目内容
3.反应条件与环境对化学反应会产生影响,下列错误的是( )| 化学反应 | 影响因素 | |
| A | H2O2不稳定,向溶液中加入少量MnO2后的分解速率明显加快 | 催化剂 |
| B | Na与O2反应既能生成Na2O也能生成Na2O2 | 温度 |
| C | 20mL双氧水比10mL双氧水产生更多的氧气 | 浓度 |
| D | 过氧化氢在酸、碱、中性条件下将高锰酸钾分别还原成Mn2+、MnO42-、MnO2 | 溶液的酸碱性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.H2O2加入少量MnO2后能加快反应速率;
B.钠和氧气在常温下生成氧化钠,在加热生成过氧化钠;
C.20mL双氧水比10mL双氧水产生更多的氧气,原因为双氧水量多;
D.过氧化氢在酸、碱、中性条件下将高锰酸钾分别还原成Mn2+、MnO42-、MnO2,说明溶液的酸碱性不同高锰酸钾氧化性不同.
解答 解:A.H2O2加入少量MnO2后能加快反应速率,所以MnO2作双氧水分解的催化剂,故A正确;
B.钠和氧气在常温下生成氧化钠,在加热生成过氧化钠,所以为反应温度不同,故A正确;
C.20mL双氧水比10mL双氧水产生更多的氧气,原因为双氧水量多生成的氧气就多,故C错误;
D.过氧化氢在酸、碱、中性条件下将高锰酸钾分别还原成Mn2+、MnO42-、MnO2,说明溶液的酸碱性不同高锰酸钾氧化性不同,故D正确.
故选C.
点评 本题考查元素化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,把握物质的性质及发生的反应为解答的关键,综合性较强,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列有关化学用语使用正确的是( )
| A. | CO2的电子式: | |
| B. | 氟化氢的形成过程: | |
| C. | 表示甲烷分子和四氯化碳分子的比例模型: | |
| D. | 次氯酸的结构式:H-O-Cl |
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| C. | 18gD2O中含有的质子数目为10NA | |
| D. | 标准状况下,11.2LSO3所含的分子数为0.5NA |
11.下列元素在自然界中以化合态存在的是( )
①Na ②Cl ③Al ④Fe.
①Na ②Cl ③Al ④Fe.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
18.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 质量为16g的O2和O3的混合气体中所含的氧原子的个数为NA | |
| B. | 18gNH4+含有质子数为10NA | |
| C. | 1mol过氧化钠与足量水反应时,转移电子的数目为2NA | |
| D. | 标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 |
8.在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中一定不存在的金属离子是( )
| A. | Fe2+和Cu2+ | B. | Fe3+ | C. | Cu2+ | D. | Fe2+ |
15.研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
请回答下列问题:
(1)NO3-中心原子的杂化类型是sp2,离子中所含大π键是π46.
(2)根据表中数据计算此待测液中c(H+)浓度a为1×10-4mol/L.
(3)NOx是汽车尾气中的主要污染物之一.
①NOx能形成酸雨,由NO2形成的酸雨中含有的主要离子有H+、NO3-.
②汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是N2+O2═2NO,在汽车尾气系统中加装催化转化器可减少NOx的污染.
(4)为减少SO2的排放,常采取的措施有:
①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是CaSO4.
②吸收烟气中的SO2,以下物质可作吸收剂的是a(填序号),写出吸收SO2过程中发生的一个反应的离子方程式2OH-+SO2═SO32-+H2O或OH-+SO2═HSO3-.
a.NaOH b.H2SO4 c.NaHSO3.
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
(1)NO3-中心原子的杂化类型是sp2,离子中所含大π键是π46.
(2)根据表中数据计算此待测液中c(H+)浓度a为1×10-4mol/L.
(3)NOx是汽车尾气中的主要污染物之一.
①NOx能形成酸雨,由NO2形成的酸雨中含有的主要离子有H+、NO3-.
②汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是N2+O2═2NO,在汽车尾气系统中加装催化转化器可减少NOx的污染.
(4)为减少SO2的排放,常采取的措施有:
①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是CaSO4.
②吸收烟气中的SO2,以下物质可作吸收剂的是a(填序号),写出吸收SO2过程中发生的一个反应的离子方程式2OH-+SO2═SO32-+H2O或OH-+SO2═HSO3-.
a.NaOH b.H2SO4 c.NaHSO3.

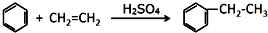
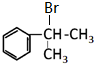 .
.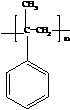 .
. ;
; ,其一氯代物有4种.
,其一氯代物有4种.