题目内容
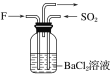
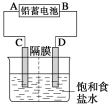
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
已知:铅蓄电池在放电时发生下列电极反应:
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式__。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为__极。
(3)用铅蓄电池电解1L饱和食盐水时
①若收集到11.2L(标准状况下)氯气,则至少转移电子__mol。
②若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为___L。
【答案】2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 正 1 22.4
2NaOH+Cl2↑+H2↑ 正 1 22.4
【解析】
(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)C极一侧滴酚酞试液不变红色,说明该极无OH-生成,C极是阳极;
(3)①依据电解氯化钠生成氯气的电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算。
(1) 惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,化学方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(2)C极一侧滴酚酞试液不变红色,说明该极无OH-生成,C极是阳极,阳极与电源正极相连,则A是正极,故答案为:正;
(3)①电解氯化钠生成氯气的电极反应为2Cl--2e-=Cl2↑,收集到11.2L(标准状况下)氯气物质的量为0.5mol,转移电子物质的量为1mol,故答案为:1;
②蓄电池消耗H2SO42mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸转移电子2mol,根据电子守恒,电解食盐水阴极电极反应2H++2e-=H2↑,转移电子也为2mol,则生成氢气1mol,标准状况体积为22.4L,故答案为:22.4。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案