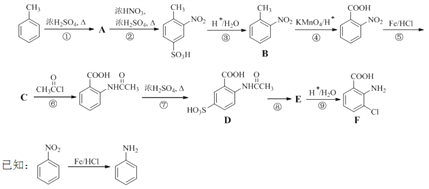
题目内容
【题目】碳元素以C—C键构成了有机界,硅元素以![]() 键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
(1)基态锗(![]() )原子的核外电子排布式为
)原子的核外电子排布式为![]() _____;
_____;![]() 分子空间构型是__________。
分子空间构型是__________。
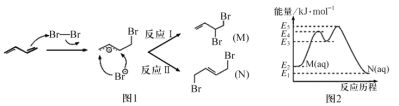
(2)![]() 发生水解的机理如图:
发生水解的机理如图:

![]() 不能按照上述机理发生水解反应,原因是____________________。
不能按照上述机理发生水解反应,原因是____________________。
(3)金刚石熔点为4440℃,晶体硅熔点为1410℃,金刚石熔点比晶体硅高的原因是_______。
(4)C和![]() 经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
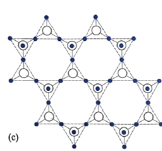
(5)在硅酸盐中,![]() 四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中
四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中![]() 原子的杂化方式为______,化学式为_______。
原子的杂化方式为______,化学式为_______。


(6)铝硅酸盐分子筛在化工领域有重要的应用。铝硅酸盐结构中![]() 价铝部分地置换
价铝部分地置换![]() 四面体结构中
四面体结构中![]() 价的硅。从结构角度分析
价的硅。从结构角度分析![]() 价铝能够置换
价铝能够置换![]() 价硅的原因是_________。
价硅的原因是_________。
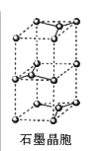
(7)石墨采取六方最密堆积方式,晶胞结构如图。晶胞参数为底边长![]() ,高
,高![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则石墨晶体的密度为_______
,则石墨晶体的密度为_______![]() 。
。
【答案】![]() 正四面体 C没有d轨道 结构相似,C原子半径小,C—C键能大 共价键有方向性和饱和性
正四面体 C没有d轨道 结构相似,C原子半径小,C—C键能大 共价键有方向性和饱和性 ![]() 杂化
杂化 ![]() 或
或![]() Al和Si的粒子大小相近
Al和Si的粒子大小相近 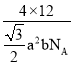 或
或![]() 或
或![]()
【解析】
(1)锗和硅是同一主族元素,均为最外层电子数为4的主族元素,故基态锗(![]() )原子的核外电子排布式为
)原子的核外电子排布式为![]()
![]() ;利用等电子体原理可知
;利用等电子体原理可知![]() 和CCl4互为等电子体,故
和CCl4互为等电子体,故![]() 分子空间构型是正四面体,故答案为:
分子空间构型是正四面体,故答案为:![]() 正四面体;
正四面体;
(2)根据![]() 发生水解的机理图可知,过程中由于Si原子上的3d空轨道中接受了H2O中O原子上的孤对电子,从而发生水解反应,而C原子只有两个电子层,L层上没有d轨道,故不能接受孤对电子,无法水解,故答案为:C没有d轨道;
发生水解的机理图可知,过程中由于Si原子上的3d空轨道中接受了H2O中O原子上的孤对电子,从而发生水解反应,而C原子只有两个电子层,L层上没有d轨道,故不能接受孤对电子,无法水解,故答案为:C没有d轨道;
(3)金刚石和晶体硅均为原子晶体,其熔点高低主要取决于其中共价键的键能大小,由于C原子半径比Si原子的小,故C-C的键长小于Si-Si的键长,一般共价键的键长越短,键能越大,故金刚石熔点比晶体硅高的原因是结构相似,C原子半径小,C—C键能大,故答案为:结构相似,C原子半径小,C—C键能大;
(4)C和![]() 经常形成原子晶体,原子晶体是通过共价键结合的,由于共价键有方向性和饱和性,决定了原子晶体周围的原子个数受到一定的限制,离子晶体则是通过阴、阳离子之间的离子键结合的,离子键没有方向性和饱和性,使得离子晶体的配位数增多,故答案为:共价键有方向性和饱和性;
经常形成原子晶体,原子晶体是通过共价键结合的,由于共价键有方向性和饱和性,决定了原子晶体周围的原子个数受到一定的限制,离子晶体则是通过阴、阳离子之间的离子键结合的,离子键没有方向性和饱和性,使得离子晶体的配位数增多,故答案为:共价键有方向性和饱和性;
(5)硅酸盐中的硅酸根(![]() )为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;图(c)为一种无限长层状结构的多硅酸根,图(b)中一个
)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;图(c)为一种无限长层状结构的多硅酸根,图(b)中一个![]() 四面体结构单元中其中有3个氧原子的贡献率为
四面体结构单元中其中有3个氧原子的贡献率为![]() ,
,![]() 四面体结构单元含有1个硅、氧原子数目=1+3×
四面体结构单元含有1个硅、氧原子数目=1+3×![]() =2.5,Si、O原子数目之比为1:2.5=2:5,故化学式为
=2.5,Si、O原子数目之比为1:2.5=2:5,故化学式为![]() 或者
或者![]() ,故答案为:sp3
,故答案为:sp3 ![]() 或者
或者![]() ;
;
(6)铝硅酸盐结构中![]() 价铝部分地置换
价铝部分地置换![]() 四面体结构中
四面体结构中![]() 价的硅,首先考虑原子的大小,原子大小相差太大,根本放不进去,而Al的半径虽然比Si的半径大一些,但还是很接近的,故
价的硅,首先考虑原子的大小,原子大小相差太大,根本放不进去,而Al的半径虽然比Si的半径大一些,但还是很接近的,故![]() 价铝能够置换
价铝能够置换![]() 价硅的原因是Al和Si的粒子大小相近,故答案为:Al和Si的粒子大小相近;
价硅的原因是Al和Si的粒子大小相近,故答案为:Al和Si的粒子大小相近;
(7)由晶胞结构图可知,1个晶胞中含有的C原子数目为![]() 个,晶胞参数为底边长
个,晶胞参数为底边长![]() ,高
,高![]() ,由于晶胞的底面是一个棱形,故一个晶胞的体积为:V=
,由于晶胞的底面是一个棱形,故一个晶胞的体积为:V=![]() a2b cm3,阿伏加德罗常数为
a2b cm3,阿伏加德罗常数为![]() ,则石墨晶体的密度为
,则石墨晶体的密度为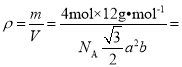
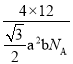
![]() ,或者进一步化简为:
,或者进一步化简为:![]() 或
或![]() ,故答案为:
,故答案为: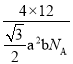 或
或![]() 或
或![]() 。
。

【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
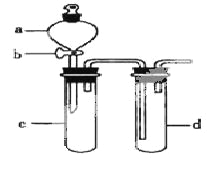
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是_________;该小组同学实验目的是_________,但此实验的不足之处是_____________________。