题目内容
7.(1)从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于D.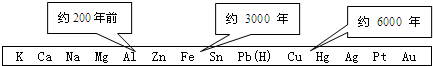
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性强弱
(2)将一小块金属钠投入水中,反应化学方程式为2Na+2H2O=2NaOH+H2↑;
可观察到的实验现象是bc,生成NaOH的电子式:
 .
.a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d..溶液变红
(3)铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
铝分别与足量的NaOH溶液和盐酸反应,若两个反应在相同状况下放出等量的气体,则反应中消耗的NaOH和HCl物质的量之比为1:3.
分析 (1)由图可以判断出金属活动性与开发利用的先后关系;
(2)钠的密度小于水,钠和水剧烈反应生成氢氧化钠和氢气且放出大量热,钠的熔点较低,氢氧化钠的电子式为: ;
;
(3)氢氧化钠溶液和铝反应生成偏铝酸钠和氢气,铝与氢氧化钠和盐酸反应的实质都是铝与氢离子之间的氧化还原反应,放出等量的气体,说明参加反应的铝相同,与氢氧化钠生成偏铝酸钠,与盐酸生成氯化铝,所以NaOH和HCl物质的量之比为1:3.
解答 解:(1)由图示可以看出金属的活动性大小与金属的开发利用的先后有关,故答案为:D;
(2)钠的密度小于水,所以会浮在水面上,熔点较低,钠和水放出大量的热,所以钠会熔成一个小球,和水反应生成氢气,生成的气体使钠受力不均,所以钠在水中到处游动,钠和水反应方程式为:2Na+2H2O=2NaOH+H2↑,氢氧化钠的电子式为: ,
,
故答案为:2Na+2H2O=2NaOH+H2↑;bc; ;
;
(3)氢氧化钠溶液和铝反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝与氢氧化钠和盐酸反应的实质都是铝与氢离子之间的氧化还原反应,放出等量的气体,说明参加反应的铝相同,与氢氧化钠生成偏铝酸钠,与盐酸生成氯化铝,所以NaOH和HCl物质的量之比为1:3,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;1:3.
点评 本题考查了钠、铝的性质,根据钠和水的反应现象探究钠的性质,结构决定性质,性质体现结构,根据钠原子和铝原子结构的不同分析其性质不同,难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
12.下列说法错误的是( )
| A. | 1mol 氢 | B. | 1mol O | C. | 1mol 二氧化碳 | D. | 1mol 水 |
18. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
1.00.50t(s)123c(mol/L)abcd
(1)已知升高温度,NO2的浓度减小,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b
用O2表示从0~2s内该反应的平均速率v=0.15mol/(L•s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 2.0 | 1.0 | 0.8 | 0.7 | 0.7 | 0.7 |
(1)已知升高温度,NO2的浓度减小,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b
用O2表示从0~2s内该反应的平均速率v=0.15mol/(L•s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
15.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | 食盐水 | B. | CO2 | C. | NaHCO3 | D. | 氢氧化钠 |
2.设nA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,11.2 L氧气含有的分子数目为nA | |
| B. | 1 mol H2所含有的电子数目为nA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 nA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2nA |
12.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯( )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
| A. | CO和CH3OH | B. | CO2和H20 | C. | H2和CO2 | D. | CH3OH和H2 |
16.用X、Y、Z、w四种金属进行如下实验:
根据以上事实.下列判断或推测错误的是( )
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生 |
| 2 | 将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z |
| A. | 上述四种金属中,Z的单质还原性最弱 | |
| B. | w的还原性强于Y的还原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可构成原电池,X作负极 |
17.下列叙述不正确的是( )
| A. | 除去镁粉中少量的铝粉,加足量氢氧化钠溶液反应后,过滤 | |
| B. | 做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸 | |
| C. | 金属钠可以保存在煤油里 | |
| D. | 可用过滤的方法除去氢氧化铁胶体中的氯化铁溶液 |
 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol