题目内容
2.设nA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 常温常压下,11.2 L氧气含有的分子数目为nA | |
| B. | 1 mol H2所含有的电子数目为nA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 nA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2nA |
分析 A.常温常压下,不能使用标况下的气体摩尔体积计算;
B.氢气分子中含有2个电子,1mol氢气中含有2mol电子;
C.4.4g二氧化碳的物质的量为0.1mol;
D.缺少溶液体积,无法计算溶液中氯离子数目.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算11.2L氧气的物质的量,故A错误;
B.1mol氢气中含有2mol电子,所含有的电子数目为2nA,故B错误;
C.4.4g二氧化碳的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,含有的二氧化碳分子数目为0.1 nA,故C正确;
D.没有告诉氯化钙溶液的体积,无法计算溶液中氯离子的数目,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
10.实验室配制1mol•L-1盐酸250mL,下列不需用的仪器是( )
| A. | 250 mL容量瓶 | B. | 托盘天平 | C. | 胶头滴管 | D. | 烧杯 |
17.下列制取单质的反应中,化合物作还原剂的是( )
| A. | Br2+2NaI═2NaBr+I2 | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | 2C+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑ | D. | 4Al+3MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$3Mn+2Al2O3 |
14.下列关于金属的腐蚀与防护的说法中正确的是( )
| A. | 舱底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| B. | 在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀 | |
| C. | 铁表面镀银,铁作阳极 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |

 .
.
 .
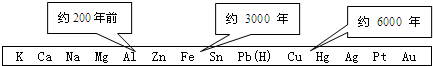
. 金属及其化合物有广泛的应用.
金属及其化合物有广泛的应用.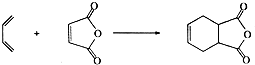
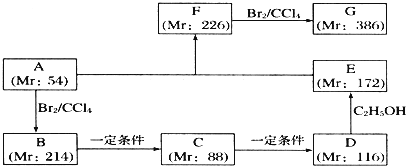
 .
.