题目内容
【题目】二氧化硫在生产和生活中有着广泛的用途。
(1)SO2可用来制备定影剂Na2S2O3,,反应的化学方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑。请用单线桥表示该反应中的电子转移情况______,还原剂与氧化剂的物质的量之比为____。
(2)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为______;吸收后的浓溶液可用图1的装置再生循环脱硫,并制得硫酸,电极a的电极反应为_____,乙是____。
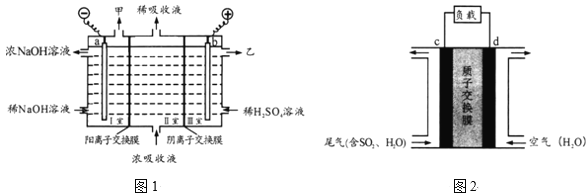
(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是______,c电极是__极,移动的离子及方向是____。
【答案】![]() 1∶2 SO2+2OH-=SO42-+H2O 2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑) 浓度较大的H2SO4溶液 化学能转化成电能 负 H+由c电极通过质子交换膜向d电极移动
1∶2 SO2+2OH-=SO42-+H2O 2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑) 浓度较大的H2SO4溶液 化学能转化成电能 负 H+由c电极通过质子交换膜向d电极移动
【解析】
(1) Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑,反应中Na2S中S的化合价由-2价升高到+2价,SO2中S的化合价由+4价降低到+2价,根据化合价的变化分析解答;
(2)用足量NaOH溶液吸收尾气中的SO2,反应生成亚硫酸钠;吸收后的浓溶液可再生循环脱硫,并制得硫酸,根据化合价的变化,结合电解池原理分析解答;
(3)二氧化硫空气质子交换膜燃料电池属于原电池,结合原电池原理分析解答。
(1) Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑,反应中Na2S中S的化合价由-2价升高到+2价,Na2S为还原剂,SO2中S的化合价由+4价降低到+2价,SO2为氧化剂,反应中的电子转移情况用单线桥表示为![]() ,还原剂与氧化剂的物质的量之比为1∶2,故答案为:
,还原剂与氧化剂的物质的量之比为1∶2,故答案为:![]() ;1∶2;
;1∶2;
(2)用足量NaOH溶液吸收尾气中的SO2,反应生成亚硫酸钠,反应的离子方程式为SO2+2OH-=SO32-+H2O;吸收后的浓溶液可再生循环脱硫,并制得硫酸,根据图示,电极a为阴极,溶液中的氢离子放电发生还原反应,电极反应为2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑),电极b为阳极,SO32-在阳极发生氧化反应生成硫酸,因此乙是浓度较大的H2SO4溶液,故答案为:SO2+2OH-=SO32-+H2O;2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑);浓度较大的H2SO4溶液;
(3)二氧化硫空气质子交换膜燃料电池属于原电池,原电池的能量转化是化学能转化成电能,二氧化硫为燃料,在负极上发生氧化反应,通入空气的电极为正极,因此c电极是负极,溶液中的氢离子由c电极通过质子交换膜向d电极移动,故答案为:化学能转化成电能;负;H+由c电极通过质子交换膜向d电极移动。