题目内容
一定质量 Cu与某浓度足量的HNO3反应,将放出的气体与1.12L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则Cu的质量为( )
| A、3.2g | B、4.8g | C、6.4g | D、10.8g |
分析:铜与硝酸反应生成硝酸铜与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,铜提供的电子等于氧气获得的电子,据此计算铜的物质的量,再根据m=nM计算铜的质量.
解答:解:因发生:HNO3
NO(NO2)
HNO3,可知整个过程,铜提供的电子等于氧气获得的电子,
n(O2)=
=0.05mol,得电子0.05mol×4=0.2mol,
则铜失去0.2mol,
n(Cu)=
=0.1mol,
m(Cu)=0.1mol×64g/mol=6.4g,
故选C.
| Cu |
| O2 |
n(O2)=
| 1.12L |
| 22.4L/mol |
则铜失去0.2mol,
n(Cu)=
| 0.2ml |
| 2 |
m(Cu)=0.1mol×64g/mol=6.4g,
故选C.
点评:本题考查氧化还原反应的有关计算,难度中等,根据反应过程判断铜通过的电子等于氧气获得的电子是关键,转移氧化还原反应中守恒思想的运用.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
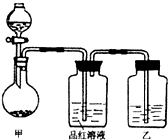 某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究. CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)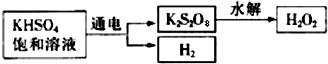
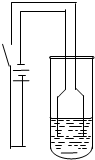 (2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
(2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究: 实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:
实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答: 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示: