题目内容
16.电子数相等的粒子叫做等电子体,下列各组粒子属于等电子体是( )| A. | CO和CO2 | B. | NO和NO2 | C. | H2S和F2 | D. | CO2和SO2 |
分析 A、CO分子含有电子数为14,CO2的电子数为22,
B、NO分子含有电子数为15,NO2的电子数为23,
C、H2S和F2的电子数目相同,都是18个电子,
D、SO2分子含有电子数为32,CO2的电子数为22,
根据题目信息,电子数目相同的微粒为等电子体,据此作判断
解答 解:A、CO分子含有电子数为14,CO2的电子数为22,二者电子数目不相等,不是等电子体,故A错误;
B、NO分子含有电子数为15,NO2的电子数为23,二者电子数目不相等,不是等电子体,故B错误;
C、H2S和F2的电子数目相同,都是18个电子,为等电子体,故C正确;
D、SO2分子含有电子数为32,CO2的电子数为22,二者电子数目不相等,不是等电子体,故D错误;
故选C.
点评 考查等电子体、学生对信息的理解与直接运用,比较基础,注意基础知识的掌握.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
6.在恒温、恒容条件下,能使A(g)+B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 减小C或D的浓度 | B. | 充入“惰性气体” | C. | 减小B的浓度 | D. | 升高温度 |
7.将一定量的Fe和CuO的混合物投入250mL 2mol/L硝酸中,反应完全后生成1.12LNO(标准状况下测得),再向反应后的溶液中加入1mol/L NaOH溶液,要使所有金属元素完全沉淀下来,所加入NaOH溶液的体积最少需( )
| A. | 400mL | B. | 450 mL | C. | 500 mL | D. | 不能确定 |
4.下列说法正确的是( )
| A. | 1 mol的 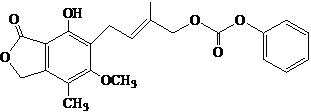 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖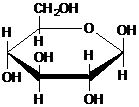 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | C3H8的所有碳原子一定在同一平面上 |
11.关于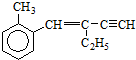 下列结论正确的是( )
下列结论正确的是( )
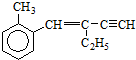 下列结论正确的是( )
下列结论正确的是( )| A. | 该有机物分子式为C13H16 | |
| B. | 该有机物分子最多有4个碳原子共直线 | |
| C. | 该有机物属于苯的同系物 | |
| D. | 该有机物分子最多有13个碳原子共平面 |
1.下列对药品的有关叙述正确的是( )
| A. | 阿司匹林肠溶片具有较强的解热镇痛和抗炎、抗风湿效用,它能防止药物对胃的刺激 | |
| B. | “胃舒平”是抗酸药,主要用于治疗胃酸分泌过多的疾病,长期服用无任何副作用 | |
| C. | 青霉素是一种天然抗生素,对人体细胞的毒性很低,对病毒引起的疾病有良好的疗效 | |
| D. | 药物作用于人体,除了有治疗功效外,还可能引起不良反应,但不会危害人体健康 |
5.NA代表阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状态下,22.4L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0g CH4中含有共价键的数目为NA | |
| C. | 标准状态下,2.24L Cl2与足量NaOH溶液反应,转移电子数目为0.1NA | |
| D. | 常温下,1molNa2O2所含的阴阳离子总数为4NA |
8.下列实验操作正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 盛放Na2SiO3溶液时,使用带玻璃塞的磨口瓶 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |