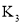题目内容
【题目】燃煤会产生![]() 、CO、
、CO、![]() 等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
Ⅰ.![]()
Ⅱ.![]()
(1)一定温度下,向某恒容密闭容器中加入![]() 和1molCO,若只发生反应Ⅰ,下列能说明该反应已达到平衡状态的是______
和1molCO,若只发生反应Ⅰ,下列能说明该反应已达到平衡状态的是______![]() 填序号
填序号![]()
![]() 容器内的压强不发生变化
容器内的压强不发生变化
b.![]()
![]() 容器内气体的密度不发生变化
容器内气体的密度不发生变化
d.![]()
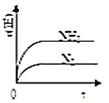
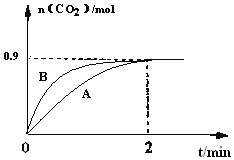
(2)一定温度下,体积为1L容器中加入![]() 和1molCO,若只发生反应Ⅱ,测得
和1molCO,若只发生反应Ⅱ,测得![]() 的物质的量随时间变化如图中曲线A所示:
的物质的量随时间变化如图中曲线A所示:
①在![]() 内的平均反应速率
内的平均反应速率![]() ______。
______。
②曲线B表示过程与曲线A相比改变的反应条件可能为______![]() 答出一条即可
答出一条即可![]() 。
。
③若要提高反应体系中![]() 的体积分数,可采取的措施为______。
的体积分数,可采取的措施为______。
(3)一定温度下,向恒容密闭容器中加入![]() 和1molCO,下列能说明反应I和反应II同时发生的是______
和1molCO,下列能说明反应I和反应II同时发生的是______![]() 填代号
填代号![]() 。
。
![]() 反应后气体能使品红褪色
反应后气体能使品红褪色
![]() 反应过程中,CO的体积分数逐渐减小
反应过程中,CO的体积分数逐渐减小
![]() 反应体系达平衡前,
反应体系达平衡前,![]() 和
和![]() 两种气体的浓度之比随时间发生变化
两种气体的浓度之比随时间发生变化
![]() 体系压强逐渐增大
体系压强逐渐增大
(4)烟道气中的![]() 和
和![]() 均是酸性氧化物,也可用氢氧化钠溶液吸收。
均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:![]() 时,碳酸和亚硫酸的电离平衡常数分别为:
时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 ![]()
亚硫酸 ![]()
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是______![]() 填标号
填标号![]() 。
。
![]() 下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
![]() 下,等浓度的
下,等浓度的![]() 溶液pH大于
溶液pH大于![]() 溶液
溶液
![]() 将
将![]() 气体通入
气体通入![]() 溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
![]() 将
将![]() 气体通入
气体通入![]() 溶液,逸出气体通入品红溶液,品红溶液不褪色
溶液,逸出气体通入品红溶液,品红溶液不褪色
②![]() 时,氢氧化钠溶液吸收烟道气,得到
时,氢氧化钠溶液吸收烟道气,得到![]() 的吸收液,该溶液中
的吸收液,该溶液中![]() :
:![]() ______。
______。
③少量![]() 溶液和
溶液和![]() 溶液反应的离子方程式为______。
溶液反应的离子方程式为______。
【答案】ac ![]() 加入催化剂
加入催化剂![]() 或增大压强
或增大压强![]() 降低温度 c ac 1:10
降低温度 c ac 1:10 ![]()
【解析】
(1)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,以此分析判断;
(2)①结合v=![]() 计算反应速率v(CO);
计算反应速率v(CO);
②曲线B表示过程与曲线A相比,曲线斜率增大,反应速率增大;
③反应Ⅱ:CaSO4(s)+CO(g)═![]() CaS(s)+CO2(g)是体积不变的放热反应,结合温度、压强、浓度等的改变对化学平衡移动的影响,分析解答;
CaS(s)+CO2(g)是体积不变的放热反应,结合温度、压强、浓度等的改变对化学平衡移动的影响,分析解答;
(3)a.反应后气体能使品红褪色,只能说明生成SO2,可能只发生反应I;
b.CO的体积分数逐渐减小,也可能只发生一个反应I;
c.反应I和反应II不同产物分别是![]() 和
和![]() ,故反应体系达平衡前,
,故反应体系达平衡前,![]() 和
和![]() 两种气体的浓度之比随时间发生变化,能说明反应I和反应II同时发生;
两种气体的浓度之比随时间发生变化,能说明反应I和反应II同时发生;
d项压强逐渐增大,说明气体物质的量增多反应1一定发生,不能说明反应II是否发生;
(4)①比较酸性强弱,可根据强酸制备弱酸、测定等浓度的pH以及溶液的导电能力判断;
②根据K2=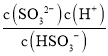 =1.0×10-7计算;
=1.0×10-7计算;
③根据电离常数判断。
(1) a.反应前后体积不等,则容器内的压强不发生变化,可说明达到平衡状态,故a正确;
![]() ,正逆反应速率不等,没有达到平衡状态,故b错误;
,正逆反应速率不等,没有达到平衡状态,故b错误;
![]() 有固体参加反应,则容器内气体的密度不发生变化,可说明达到平衡状态,故c正确;
有固体参加反应,则容器内气体的密度不发生变化,可说明达到平衡状态,故c正确;
![]() ,说明气体的物质的量不发生变化,不能说明是否达到平衡状态,故d错误;
,说明气体的物质的量不发生变化,不能说明是否达到平衡状态,故d错误;
故答案为:ac;
(2)一定温度下,体积为1L容器中加入![]() 和1molCO,若只发生反应Ⅱ,图中2min达到平衡状态,二氧化碳物质的量
和1molCO,若只发生反应Ⅱ,图中2min达到平衡状态,二氧化碳物质的量![]() ,
,
①![]() 达到平衡状态消耗一氧化碳物质的量
达到平衡状态消耗一氧化碳物质的量![]() ,
,
在![]() 内的平均反应速率
内的平均反应速率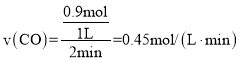
故答案为:![]() ;
;
②曲线B表示过程与曲线A相比,曲线斜率增大,反应速率增大,可为加入催化剂![]() 或增大压强
或增大压强![]() ,
,
故答案为:加入催化剂![]() 或增大压强
或增大压强![]() ;
;
③反应Ⅱ:![]() 是体积不变的放热反应,若要提高反应体系中
是体积不变的放热反应,若要提高反应体系中![]() 的体积分数,需要平衡正向进行,反应为放热反应,降低温度反应正向进行,
的体积分数,需要平衡正向进行,反应为放热反应,降低温度反应正向进行,
故答案为:降低温度;
(3) a.反应后气体能使品红褪色,只能说明生成SO2,可能只发生反应I,故a错误;
b.CO的体积分数逐渐减小,也可能只发生一个反应I,故b错误;
c.反应I和反应II不同产物分别是![]() 和
和![]() ,故反应体系达平衡前,
,故反应体系达平衡前,![]() 和
和![]() 两种气体的浓度之比随时间发生变化,能说明反应I和反应II同时发生,故c正确;
两种气体的浓度之比随时间发生变化,能说明反应I和反应II同时发生,故c正确;
d项压强逐渐增大,说明气体物质的量增多反应1一定发生,不能说明反应II是否发生,故d错误;
故答案为:c;
(4)① ![]() 下,二者的溶解度不同,饱和碳酸溶液pH大于饱和亚硫酸溶液pH,不能用于比较酸性的强弱,故a错误;
下,二者的溶解度不同,饱和碳酸溶液pH大于饱和亚硫酸溶液pH,不能用于比较酸性的强弱,故a错误;
![]() 酸性越强,对应的盐类水解的程度越弱,则
酸性越强,对应的盐类水解的程度越弱,则![]() 下,等浓度的
下,等浓度的![]() 溶液pH大于
溶液pH大于![]() 溶液,可说明亚硫酸的酸性强,故b正确;
溶液,可说明亚硫酸的酸性强,故b正确;
![]() 将
将![]() 气体通入
气体通入![]() 溶液,逸出气体可能是二氧化硫,通入澄清石灰水,澄清石灰水变浑浊,不能说明生成二氧化碳,不能说明亚硫酸的酸性强,故c错误;
溶液,逸出气体可能是二氧化硫,通入澄清石灰水,澄清石灰水变浑浊,不能说明生成二氧化碳,不能说明亚硫酸的酸性强,故c错误;
![]() 将
将![]() 气体通入
气体通入![]() 溶液,逸出气体通入品红溶液,品红溶液不褪色,说明二氧化碳与亚硫酸钠不反应,则亚硫酸酸性强,故d正确;
溶液,逸出气体通入品红溶液,品红溶液不褪色,说明二氧化碳与亚硫酸钠不反应,则亚硫酸酸性强,故d正确;
故答案为:ac;
②由根据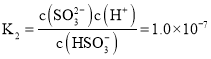 可知,
可知,![]() :
:![]() :
:![]() :10,
:10,
故答案为:1:10;
③由电离常数可知,亚硫酸的酸性比碳酸强,但亚硫酸的酸性比碳酸的弱,则反应的离子方程式为![]() ,
,
故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g) + 4H2(g)CH3OCH3(g) + H2O(g) △H<0,测得反应的相关数据如下表:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 0.2mol CO 0.4mol H2 | 0.4mol CO 0.8mol H2 | 0.2mol CH3OCH3 0.2mol H2O |
平衡v(CO)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡n(H2)/(mol) | 0.2 | n2 | n3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(CO) | a2(CO) | a3(CH3OCH3) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.v1<v2,n2>0.4B.K2=2.5×103,p2>p3
C.2p1<p3,a1(CO) >a2(CO)D.n3<0.4,a2(CO) + a3(CH3OCH3)<1