题目内容
15.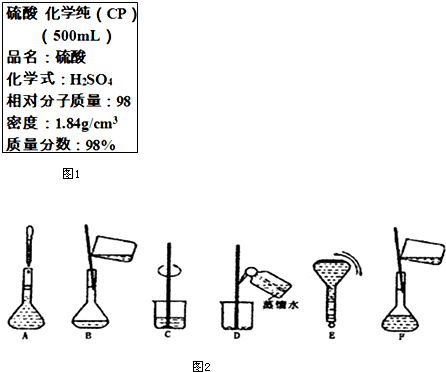 如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,
如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,则:(1)需要该浓硫酸的体积为62.5mL;
(2)可供选用的仪器有:胶头滴管;烧瓶;烧杯;药匙;量筒;托盘天平.配置稀硫酸时,还缺少的仪器有玻璃棒、250mL的容量瓶
(3)配置过程中有几个关键的步骤和操作如图2所示:将下列实验步骤A-F按实验过程先后次序排列CBDFAE
(4)该同学实际配置得到的浓度为4.5mol/L,可能的原因是AD
A、量取浓H2SO4时俯视刻度
B、容量瓶洗净后未经干燥处理
C、将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D、定容时仰视刻度线.
分析 (1)需要240mL 4.66mol/L的稀硫酸,实际配制时需要配制250mL稀硫酸溶液,计算出浓硫酸的浓度,然后根据稀释过程中溶质的物质的量不变计算出需要改浓硫酸的体积;
(2)根据配制一定物质的量浓度的溶液的配制步骤选择仪器;
(3)根据配制一定物质的量浓度的溶液的步骤进行排序;
(4)配制的浓度偏小,根据操作对c=$\frac{n}{V}$的影响进行判断.
解答 解:(1)该浓硫酸中含有的硫酸的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L;验室需要240mL 4.6mol/L的稀硫酸,实际配制时需要配制250mL的稀硫酸,
需要硫酸的物质的量为:4.6mol/L×0.25L=1.15mol,需要浓硫酸体积为:$\frac{1.15mol}{18.4mol/L}$=0.0625L=62.5mL,
故答案为:62.5;
(2)配制一定物质的量浓度的溶液的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容等,需要的仪器有:量筒、烧杯、胶头滴管、玻璃棒、250mL容量瓶,所以还需要玻璃棒和250mL容量瓶,
故答案为:玻璃棒;250mL的容量瓶;
(3)配制一定物质的量浓度的溶液的步骤有:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀,所以正确顺序为:CBDFAE,
故答案为:CBDFAE;
(4)该同学实际配置得到的浓度为0.45mol/L,说明配制的溶液的浓度偏低,
A.量取浓H2SO4时俯视刻度,导致量取的浓硫酸的体积偏小,溶质硫酸的物质的量浓度偏低,故A正确;
B.容量瓶洗净后未经干燥处理,对配制结果不会产生影响,故B错误;
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作,没有冷却,导致冷却后配制的溶液的体积偏小,溶液的浓度偏大,故C错误;
D.定容时仰视刻度线,加入的蒸馏水体积偏大,则配制的溶液的浓度偏小,故D正确;
故答案为:AD.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度中等,涉及了配制溶液时仪器的选择、物质的量难度的计算及误差分析等知识,注意掌握配制一定物质的量浓度的溶液方法,明确误差分析的方法与技巧.

 口算题天天练系列答案
口算题天天练系列答案 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )| A. | p1>p2,T1<T2,m+n>q,△H<0 | B. | p1<p2,T1>T2,m+n>q,△H>0 | ||
| C. | p1>p2,T1<T2,m+n<q,△H<0 | D. | p1<p2,T1>T2,m+n<q,△H>0 |
| A. | 生成NH3的物质的量与消耗NH3的物质的量相等 | |
| B. | 消耗1molN2,同时消耗3molH2 | |
| C. | N2、H2、NH3在密闭容器中共存 | |
| D. | 正、逆反应速率都等于0 |
| A. | 同温下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大 | |
| B. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多 | |
| C. | 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 | |
| D. | 除去溶液中的Mg2+,用OH-比CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的小 |
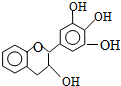 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 遇FeCl3溶液发生显色反应且能发生水解反应 |
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置来制取乙酸乙酯.试回答下列问题: