题目内容
【题目】碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率.
①该反应的离子方程式为 .
②设计实验方案:通过测量计算反应速率
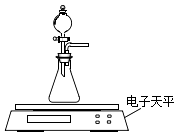
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1molL﹣1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①﹣⑥所代表的必要数据或物理量
物理量 | V(0.1molL﹣1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
实验1 | a | b | 0 | c | d | |
实验2 | 0 | c | d | |||
实验3 | c | 0 | d |
【答案】
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间
(2)生成等质量二氧化碳所需时间;a;b;b;d
【解析】解:(1)①碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;②可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率,
故答案为:生成二氧化碳的体积和反应时间;消耗碳酸钙固体的质量和反应时间;(2)①在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率,
故答案为:生成等质量二氧化碳所需时间;②据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验,
物理量 | V(0.1mol/L的HCl)/mL | m(块状碳酸钙质量)/g | m(粉末状碳酸钙质量)/g | V(蒸馏水)/mL | m(二氧化碳)/g | 反应时间 |
实验1 | a | b | c | d | ||
实验2 | a | b | c | d | ||
实验3 | c | b | a | d |
表中①﹣⑥所代表的必要数据或物理量分别为:①a ②b ③b ④a ⑤m(CO2)/g ⑥时间/s,
故答案为:①a; ②b;③b; ④a; ⑤m(CO2)/g;⑥时间/s.
(1)①碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,据此书写化学方程式;②测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率,可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率;(2)(i)在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率;(ⅱ)据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验.