题目内容
【题目】下列说法不正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 原电池中发生的反应达到平衡时,该电池无电流产生
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
【答案】C
【解析】A.Na与水反应为固体与液态反应生成气体,该反应为熵增反应,即△S>0,反应中钠熔化为小球,说明反应放出大量的热,即△H<0,则△G=△H-T△S<0,故该反应自发进行,故A正确;B.原电池中发生的反应达平衡时,各组分浓度不再改变,电子转移总量为0,该电池无电流产生,故B正确;C.FeCl3和MnO2对H2O2分解催化效果不相同,同等条件下H2O2分解速率的改变不相同,故C错误;D.NH4Cl溶液中铵根离子水解呈酸性,消耗Mg(OH)2(s)溶解平衡中的氢氧根离子,使Mg(OH)2(s)Mg2+(aq)+2OH-(aq)平衡右移,故Mg(OH)2可溶于NH4Cl溶液,故D正确;故选C。

【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
【题目】下列实验的操作、现象和解释或结论都正确的是
操作 | 现象 | 解释或结论 | |
A | 将饱和Na2SO4溶液加入到饱和石灰中 | 有白色沉淀 | 说明Ksp[Ca(OH)2]大于Ksp[CaSO4] |
B |
| 试剂瓶中有一段稳定水柱 | 装置气密性良好 |
C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | A13+水解生成Al(OH)3 |
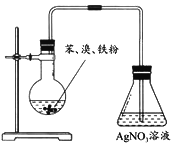
D |
| 锥形瓶溶液产生淡黄色沉淀 | 苯与溴发生取代反应 |
A. A B. B C. C D. D