题目内容
将足量的CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2的体积(已经折算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法不正确的是( )
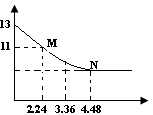

| A.NaOH溶液的物质的量浓度为0.1mol/L |
| B.NaOH溶液的体积为2L |
| C.M点离子浓度的大小关系满足c(HCO3-)>c(CO32-) |
| D.M、N点对应的纵坐标均大于7 |
C
本题主要考查CO2与NaOH反应的顺序与产物的对应关系,并根据图象数据进行相应的计算。在通入CO2气体之前,pH=13,说明c(NaOH)=0.1mol·L-1;在N点,PH不再发生变化,说明NaOH完全消耗,反应为NaOH+CO2=NaHCO3,因为n(CO2)=0.2mol,所以n(NaOH)= n(CO2)=0.2mol,V(NaOH)=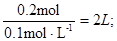 在M点,n(CO2)=0.1mol,发生反应为2NaOH+CO2=Na2CO3+H2O,CO32-+H2O
在M点,n(CO2)=0.1mol,发生反应为2NaOH+CO2=Na2CO3+H2O,CO32-+H2O HCO3-+OH-;CO32-水解产生HCO3-,所以c(CO32-)>c(HCO3-);在N点,HCO3-+H2O
HCO3-+OH-;CO32-水解产生HCO3-,所以c(CO32-)>c(HCO3-);在N点,HCO3-+H2O H2CO3+OH-,溶液呈碱性。
H2CO3+OH-,溶液呈碱性。
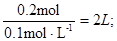 在M点,n(CO2)=0.1mol,发生反应为2NaOH+CO2=Na2CO3+H2O,CO32-+H2O
在M点,n(CO2)=0.1mol,发生反应为2NaOH+CO2=Na2CO3+H2O,CO32-+H2O HCO3-+OH-;CO32-水解产生HCO3-,所以c(CO32-)>c(HCO3-);在N点,HCO3-+H2O
HCO3-+OH-;CO32-水解产生HCO3-,所以c(CO32-)>c(HCO3-);在N点,HCO3-+H2O H2CO3+OH-,溶液呈碱性。
H2CO3+OH-,溶液呈碱性。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 、
、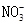 、
、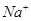 、
、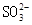
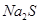 溶液中
溶液中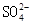 、
、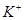 、
、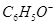 、
、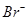
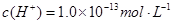 溶液中
溶液中 、
、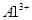
 的
的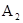 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________;



