��Ŀ����
��12�֣����ֽⷴӦ����ѧ��ѧ�г�����һ�ַ�Ӧ���͡�
��1����֪�ڳ����²��Ũ�Ⱦ�Ϊ0.1mol/L������6����Һ��pH��

���ֽ��������һ�����ɣ�һ�ֽ�ǿ������һ�ֽ�������ο����Է��ط�Ӧ�����ɽ�����ͽ�ǿ����Σ��磺2CH3COOH+Na2CO3===2CH3COONa+CO2��+H2O���������Ƕȿ�����ͬʱ��ʾ����һ�����ɣ������Խ�ǿ�����ʷ������Ʒ�Ӧ�������ɼ��Խ�ǿ�����ʡ����ոù��ɣ����ж����з�Ӧ���ܳ������� ������ĸ��ţ���
A��CO2+H2O+2NaClO===Na2CO3+2HClO
B��CO2+H2O+NaClO===NaHCO3+HClO
C��CH3COOH+NaOH===CH3COONa+HCN
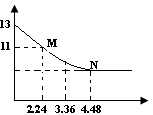
��2������������Ϣ�жϣ�������Ũ�Ⱦ�Ϊ0.05mol/L������5�����ʵ���Һ�У�pH��С���� ������ţ�����pHΪ ������ֵ����pH������ ������ţ���
��HCN ��CH3COOH ��HClO4 ��HClO ��H2SO4
��3����֪��Һ��������KSP��AgI��=9.3��10-17��KSP��AgCl��=1.8��10-10���ֽ�KI��Һ��AgCl�����Ͻ��裬����ܻ�۲쵽�������� �������ӷ�Ӧ����ʽΪ ��
��1����֪�ڳ����²��Ũ�Ⱦ�Ϊ0.1mol/L������6����Һ��pH��

���ֽ��������һ�����ɣ�һ�ֽ�ǿ������һ�ֽ�������ο����Է��ط�Ӧ�����ɽ�����ͽ�ǿ����Σ��磺2CH3COOH+Na2CO3===2CH3COONa+CO2��+H2O���������Ƕȿ�����ͬʱ��ʾ����һ�����ɣ������Խ�ǿ�����ʷ������Ʒ�Ӧ�������ɼ��Խ�ǿ�����ʡ����ոù��ɣ����ж����з�Ӧ���ܳ������� ������ĸ��ţ���
A��CO2+H2O+2NaClO===Na2CO3+2HClO
B��CO2+H2O+NaClO===NaHCO3+HClO
C��CH3COOH+NaOH===CH3COONa+HCN
��2������������Ϣ�жϣ�������Ũ�Ⱦ�Ϊ0.05mol/L������5�����ʵ���Һ�У�pH��С���� ������ţ�����pHΪ ������ֵ����pH������ ������ţ���
��HCN ��CH3COOH ��HClO4 ��HClO ��H2SO4
��3����֪��Һ��������KSP��AgI��=9.3��10-17��KSP��AgCl��=1.8��10-10���ֽ�KI��Һ��AgCl�����Ͻ��裬����ܻ�۲쵽�������� �������ӷ�Ӧ����ʽΪ ��

�Ų��ܳ�������A���ɱ������ݣ�����H2CO3>HClO>HCO3�D,CO2��NaClO��H2O=NaHCO3��HClO;
��pH��С������������ţ���H2SO4��ǿ�ᣬc(H��)= 0.05mol/L��2=0.1mol/L,��pHΪ1������ֵ����HCN����������pH��������
��AgI�ܽ��С����ɫ����ת��Ϊ��ɫ��I�D��AgCl
 AgI��Cl�D
AgI��Cl�D
��ϰ��ϵ�д�
�����Ŀ
 ��SO
��SO ��Cl��
��Cl��
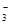 ��SCN��
��SCN��