题目内容
【题目】已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如图(部分反应产物已略去)。
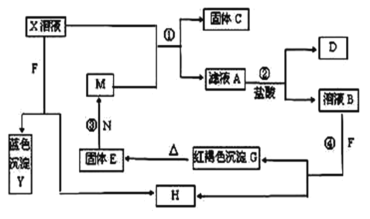
请回答下列问题:
(1)固体E的化学式为___________,写出H的化学式为___________
(2)在反应①②③④中属于置换反应的是___________(填序号)。
(3)反应②的离子方程式为___________________________。
(4)X溶液与F反应的总化学方程式为___________。
(5)若向100mL盐X的溶液中加入10g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为_____________。(假设溶液体积不变)
【答案】Fe2O3 O2 ①③ 3Fe2++![]() +4H+=3Fe3++NO↑+2H2O 2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑ 0.2mol/L
+4H+=3Fe3++NO↑+2H2O 2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑ 0.2mol/L
【解析】
F为淡黄色固体,应为Na2O2,蓝色沉淀Y为Cu(OH)2;N的最高价氧化物是耐火材料,应为Al2O3,则N为Al;过氧化钠与水反应生成的H为O2;D为无色气体,在空气中会出现红棕色,则D为NO,说明X为Cu(NO3)2;由A→D生物反应可知A中含有Fe2+,则M为Fe、C为Cu、G应为Fe(OH)3、E为Fe2O3。E可以与N反应,N的最高价氧化物是耐火材料,应为Al2O3,则N为Al。结合物质的性质和题目的要求解答该题。
(1)由以上分析可知E为Fe2O3,H的化学式为O2,故答案为:Fe2O3;O2;
(2)根据题中反应转化关系可知,反应①③都有单质参加和生成,为置换反应,②④没有单质生成,肯定不是置换反应,故答案为:①③;
(3)反应②为Fe2+与NO3在酸性条件下发生氧化还原反应,反应的离子方程式为3Fe2++![]() +4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++
+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++![]() +4H+==3Fe3++NO↑+2H2O;
+4H+==3Fe3++NO↑+2H2O;
(4) Cu(NO3)2溶液与Na2O2反应,过氧化钠与水反应,2NaO+2HO=4NaOH+O↑,生成的氢氧化钠与硝酸铜反应:Cu(NO3)2+2NaOH= Cu(OH)2↓+2NaNO3,总化学方程式为2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑,故答案为:2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑;
(5)反应为Fe+Cu2+=Cu+Fe2+,n(Fe)=![]() =0.18mol,如全部生成Cu,n(Cu)=0.18mol×64g/mol=11.4g,但得10.16g固体,说明Fe过量,则可用差量法计算,
=0.18mol,如全部生成Cu,n(Cu)=0.18mol×64g/mol=11.4g,但得10.16g固体,说明Fe过量,则可用差量法计算,
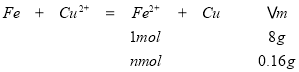
解得:n=0.02mol,c=n÷V=0.02mol÷0.1L=0.2mol/L,故答案为:0.2 mol/L.。

【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。


