题目内容
【题目】已知某纯碱(Na2CO3)试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
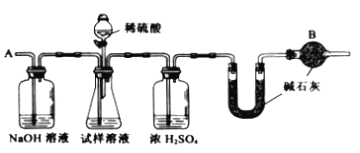
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰(CaO与NaOH固体混合物)的U型管的质量,称得为b g;
④从分液漏斗滴入6 mol·L-1 的硫酸,直到不再产生气体时为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U型管的质量;
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,最终称得为c g;
请填空和回答问题:
(1)装置中干燥管B的作用是__________________________________________
(2)步骤⑤的目的是__________________________________________________
(3)步骤⑦的目的是__________________________________________________
(4)该试样中纯碱的质量分数的计算式为___________________
【答案】防止空气中的CO2和水蒸气进入U型管中 把反应产生的CO2吹入U型管中被碱石灰吸收 保证反应产生的CO2全部被U型管中的碱石灰吸收 106(c-b)/44a×100%
【解析】
(1)根据测定混合物中的碳酸钠,是准确测定和酸反应生成的二氧化碳气体的量,避免空气中的二氧化碳进入考虑;因为空气中也有二氧化碳和水分,干燥管B的作用就是不让它们进入的;
(2)因为反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是为了驱赶它们的;
(3)就是为了将二氧化碳全部赶过去;
(4)根据U型管的质量的增加量就是生成的二氧化碳的质量,根据二氧化碳的质量算出碳酸钠的质量,再用碳酸钠的质量除以样品质量即可。
(1)U型管中的碱石灰是为了吸收反应生成的二氧化碳,但空气中也存在二氧化碳,干燥管B的作用就是防止空气中的二氧化碳和水分进入U型管,对结果产生误差;
因此,本题正确答案是:防止空气中的CO2和水蒸气进入U型管中;
(2)因为反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是将残留的二氧化碳完全排入U型管;
因此,本题正确答案是:把反应产生的CO2吹入U型管中被碱石灰吸收;
(3)直到U型管的质量基本不变,说明二氧化碳已经被全部排到U型管中;
因此,本题正确答案是:保证反应产生的CO2全部被U型管中的碱石灰吸收;
(4)设需要碳酸钠的质量为x则:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x c-b
列比例式:![]() =
=![]() ,
,
计算得出x=![]() ;
;
所以试样中纯碱的质量分数的计算式为106(c-b)/44a×100%。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】下图为元素周期表的一部分:

(1)元素③的基态原子轨道表示式为_________________。
(2)元素⑩原子的外围电子排布式为__________。
(3)元素③④⑤的第一电离能由大到小的顺序为___________(填元素符号),其简单离子半径由大到小的顺序为______________(填离子符号)。
(4)⑤与⑧气态氢化物中沸点较高的是_______(填化学式),原因是______________。
(5)以下组合的原子间反应最容易形成离子键的是_____(选填A、B、C、D,下同),最容易形成共价键的是_____,用电子式表示该共价化合物的形成过程______________。
A.和⑤ B.和⑤
C.⑤和⑥ D.⑥和⑧
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_________________________________________________。
(7)根据下列五种元素的第一至第四电离能数据(单位:KJ·mol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是_________(填元素代号)。
②若T为第三周期元素,则T属于________(填“s”、“p”、“d”、“ds”)区元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物属于__(填“共价”或“离子”)化合物。