��Ŀ����
����Ŀ����ͼΪԪ�����ڱ���һ���֣�
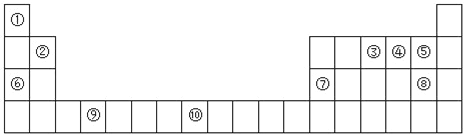
��1��Ԫ�آ۵Ļ�̬ԭ�ӹ����ʾʽΪ_________________��
��2��Ԫ�آ�ԭ�ӵ���Χ�����Ų�ʽΪ__________��
��3��Ԫ�آۢܢݵĵ�һ�������ɴ�С��˳��Ϊ___________����Ԫ�ط��ţ���������Ӱ뾶�ɴ�С��˳��Ϊ______________�������ӷ��ţ���
��4���������̬�⻯���зе�ϸߵ���_______���ѧʽ����ԭ����______________��
��5��������ϵ�ԭ�Ӽ䷴Ӧ�������γ����Ӽ�����_____��ѡ��A��B��C��D����ͬ�����������γɹ��ۼ�����_____���õ���ʽ��ʾ�ù��ۻ�������γɹ���______________��
A���͢� B���͢�
C���ݺ͢� D���͢�
��6��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ�آ���Ԫ�آڵĵ��ʼ��仯���������Ƶ����ʣ�д��Ԫ�آڵ������������NaOH��Һ��Ӧ�����ӷ���ʽ_________________________________________________��
��7��������������Ԫ�صĵ�һ�����ĵ��������ݣ���λ��KJ��mol��1�����ش�������⣺
Ԫ�ش��� | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
�������ڱ��У�����ܴ���ͬһ�������_________����Ԫ�ش��ţ���
����TΪ��������Ԫ�أ���T����________���s������p������d������ds������Ԫ�أ�Z�ǵ�������Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ���T��Z�γɵĻ���������__������ۡ������ӡ��������
���𰸡� ![]() 3d64s2 F��N��O N3����O2����F- HF HF���γɷ��Ӽ���� C B
3d64s2 F��N��O N3����O2����F- HF HF���γɷ��Ӽ���� C B ![]() 2OH��+BeO=BeO22��+H2O R ��U p ����
2OH��+BeO=BeO22��+H2O R ��U p ����
��������(1). ��ΪNԪ����N��7��Ԫ������̬ԭ�ӵ����Ų�ʽΪ��1s22s22p3�����̬ԭ�ӹ����ʾʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2). ��ΪFeԪ�أ�Fe��26��Ԫ�أ�ԭ�ӵ���Χ�����Ų�ʽΪ��3d64s2���ʴ�Ϊ��3d64s2��
(3). Ԫ�آۢܢݷֱ�ΪN��O��F��ͬһ���ڴ������ң���һ�����ܳ��������ƣ�������Ԫ����FԪ�صĵ�һ���������NԪ�صĻ�̬ԭ�ӵ����Ų�ʽΪ��1s22s22p3����һ�ְ�������ȶ��ṹ����һ������N��O������N��O��F����Ԫ�صĵ�һ�������ɴ�С��˳��ΪF��N��O��N��O��F����Ԫ�صļ����Ӿ�����ͬ�ĵ��Ӳ�ṹ��ԭ������Խ�����Ӱ뾶ԽС������N��O��F����Ԫ�صļ����Ӱ뾶�ɴ�С��˳��Ϊ��N3����O2����F�����ʴ�Ϊ��F��N��O��N3����O2����F����
(4). ��HF����֮��������������HF�ķе����HCl���ʴ�Ϊ��HF��HF���γɷ��Ӽ������
(5). �ɸ����������ڱ��е�λ�ÿ�֪����ΪH����ΪBe����ΪF����ΪNa����ΪCl������Ԫ��������õĽ����ƺ�����õķǽ�����֮���������γ����Ӽ�����ΪC��ǽ���Ԫ��֮���������γɹ��ۼ�����ΪB��û�����ΪHF��H��Fԭ��֮���γ�һ�����õ��Ӷԣ��õ���ʽ��ʾHF�γɹ��̵�ʽ��Ϊ��![]() ���ʴ�Ϊ��C��B��
���ʴ�Ϊ��C��B��![]() ��
��
(6). Be��AlԪ�صĵ��ʼ��仯����������Ƶ����ʣ���BeOҲ�������ԣ�BeO��NaOH��Һ��Ӧ����Na2BeO2��ˮ���÷�Ӧ�����ӷ���ʽΪ��2OH��+BeO=BeO22��+H2O���ʴ�Ϊ��2OH��+BeO=BeO22��+H2O��
(7).��Ԫ�صĵ����ܿ��Կ�����Q�ĵ����ܴܺ���Ϊ����Ԫ�أ�R��U�ĵ�һ�����ܽ�С���ڶ������ܾ������ʱ���+1�ۣ�����������Ϊ1������λ��ͬһ���壬E�ĵ�һ���ڶ������ܽ�С�����������ܾ������ʱ���+2�ۣ�����������Ϊ2��T�ĵ�һ���ڶ������������ܽ�С�����ĵ����ܾ���������+3�ۣ�����������Ϊ3��
��. R��U�ĵ�һ�����ĵ����ܱ仯�������ƣ���R��U�������ͬһ���壬�ʴ�Ϊ��R��U��
��. ������������֪��T�ĵ�һ���ڶ������������ܽ�С�����ĵ����ܾ���������+3�ۣ�����������Ϊ3����TΪ��������Ԫ�أ���TΪAlԪ�أ�AlԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ��1s22s22p63s23p1������p��Ԫ�أ�Z�ǵ�������Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ���Z��ClԪ�أ�Al��ClԪ��֮��縺������С���Թ��ۼ������γ�AlCl3������AlCl3�ǹ��ۻ�����ʴ�Ϊ��p�����ۡ�

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�����Ŀ��ijʵ�����С��������һ�ִӷϾɵĺ�������(��Ҫ�ɷ�ΪNiO������Fe2O3��CaO��CuO��BaO�ȣ����������¹��ա�������������ͼ��

�ش�����������
��1����������Ҫ�ɷ�ΪCaSO4����2H2O��_______________�������ʡ�
��2����ͼ��ʾ���Ľ��������¶ȵĹ�ϵ���������¶ȸ���70��ʱ�����Ľ����ʽ�������������Ni(OH)2����������ԭ����_____________________________��

��3�����������еġ�����Ʒ��Ϊ________���ѧʽ����
��4����֪�й��������↑ʼ�����ͳ�����ȫ��pH ���±���
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.7 | 9.7 | 9.2 |
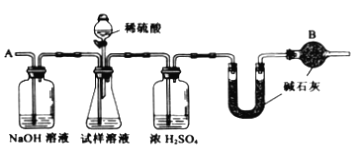
����B��Ϊ�˳�ȥ��Һ�е���Ԫ�أ�ijͬѧ���������ʵ�鷽���������A���õ���Һ�м���NaOH��Һ��������ҺpHΪ3.7��7.7�����ã����ˡ���Ը�ʵ�鷽���Ƿ���ȷ�����жϲ����������� ___________________________________����ԭ������ȷ����˵�����ɣ���ԭ������������Ը�������
��5������C��Ϊ�˳�ȥ��Һ�е�Ca2+����������Һ��F��Ũ��Ϊ3��10-3mol��L-1������Һ��![]() =________________��������ʱ��Ksp(CaF2)=2.7��10-11��
=________________��������ʱ��Ksp(CaF2)=2.7��10-11��
��6��������2NiOOH��H2O��ԭ����������
�ټ���������Cl-������������ΪClO-������1mol ClO-������OH-______________mol��
��Ni2+��ClO-��������2NiOOH��H2O��������ò���Ӧ�����ӷ���ʽΪ_________________________��
����Ŀ����������Ԫ�أ�����A��B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⡣
AԪ�صĺ���������͵��Ӳ�����ȣ�Ҳ����������ḻ��Ԫ�� |
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��� I1��738 kJ/mol��I2��1 451 kJ/mol��I3��7 733 kJ/mol��I4��10 540 kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص������������������IJ�Ϊ4 |
F��ǰ�������е縺����С��Ԫ�� |
G�����ڱ��ĵ����� |
��1����֪BA5Ϊ���ӻ����д�������ʽ______________________________��
��2��B��̬ԭ����������ߵĵ��ӣ���������ڿռ���________������ԭ�ӹ����________�Ρ�
��3��ijͬѧ����������Ϣ���ƶ�C��̬ԭ�ӵĺ�������Ų�Ϊ![]() ��ͬѧ�����ĵ����Ų�ͼΥ����_____________________________________��
��ͬѧ�����ĵ����Ų�ͼΥ����_____________________________________��
��4��Gλ��________��________�����۵����Ų�ʽΪ________��
��5������FԪ�صķ�����________������ԭ�ӽṹ��֪ʶ���Ͳ����������ԭ����_____________________________________________________________��