题目内容
在25℃的条件下,下列各组离子一定能在指定环境中大量共存的是
A.在c(H+)=10-10 mol/L的溶液中: Al3+、NH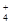 、Cl- 、NO 、Cl- 、NO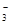 |
B.pH=13的溶液中:K+ 、Na+、SO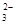 、Cl- 、Cl- |
C.pH=2的溶液中: K+、NH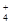 、Cl-、ClO- 、Cl-、ClO- |
D.甲基橙呈红色的溶液中:Fe3+、Na+ 、SO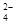 、CO 、CO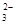 |
B
解析试题分析:能大量共存,说明离子之间互不发生反应。A选项,c(H+)=10-10 mol/L说明该溶液是碱性溶液,而铝离子,铵根离子不能在碱性溶液中共存,所以A选项是错误的。C选项pH=2说明该溶液是酸性溶液,在酸性溶液中,次氯酸根离子与氢离子会生成弱电解质次氯酸,因此C选项是错误的。D选项使甲基橙呈红色的溶液说明溶液呈酸性,而碳酸根离子与氢离子会发生反应,因此D选项是错误的。
考点:考查离子共存问题的相关知识点

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列反应的离子方程式正确的是
| A.氯气与烧碱溶液反应:Cl2+H2O=Cl-+ClO-+2H+ |
| B.向氯化亚铁溶液中滴入氯水: 2Fe2+ + Cl2 ="=" 2Fe3++ 2Cl- |
| C.AlCl3溶液中加入过量的烧碱溶液:Al3+ + 3OH-== Al(OH)3↓ |
| D.小苏打溶液中加入过量的澄清石灰水:Ca2++OH-+HCO3- ="=" CaCO3↓+H2O |
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。
(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。
根据上述实验情况,以下说法错误的是( )。
| A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32- |
| B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I- |
| C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3- |
| D.向该混合溶液中滴加酚酞试液后呈红色 |
粒子甲与粒子乙在溶液中的转化关系如下图所示,粒子甲不可能是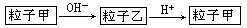
| A.NH4+ | B.Al | C.HCO3一 | D.SO2 |
下列反应的离子方程式正确的是( )
| A.NaHCO3溶液中加入盐酸:CO32-+ 2H+ = CO2↑+ H2O |
B.紫色石蕊试液中滴入氢硫酸变红的原因是:H2S 2H+ + S2- 2H+ + S2- |
| C.将NaHSO4溶液滴入Ba(OH)2溶液中至pH=7:2H+ + SO42-+ 2OH-+ Ba2+ = BaSO4↓+ 2H2O |
D.电解CuSO4溶液:Cu2+ + 2H2O Cu + O2↑+ 4H+ Cu + O2↑+ 4H+ |
下列表示对应化学反应的离子方程式正确的是
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O ="==" Al(OH)3↓+3H+ |
| C.Na2O2溶于水产生O2:Na2O2+H2O ="==" 2Na++2OH-+O2↑ |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2++OH-="==" CaCO3↓+H2O |
