题目内容
填空题(共7分)
(1)SO2到品红溶液,溶液褪色,SO2体现______性。
(2)SO2到酸性高锰酸钾溶液,溶液褪色,SO2体现_____性
(3)SO2到紫色石蕊溶液,溶液变____, SO2体现______性
(4)过量的氯气通到紫色石蕊溶液,溶液先变_____,后_____, 最终溶液为
__________色。
(1)SO2到品红溶液,溶液褪色,SO2体现______性。
(2)SO2到酸性高锰酸钾溶液,溶液褪色,SO2体现_____性
(3)SO2到紫色石蕊溶液,溶液变____, SO2体现______性
(4)过量的氯气通到紫色石蕊溶液,溶液先变_____,后_____, 最终溶液为
__________色。
(各1分,共7分)漂白,还原,红,酸,红,褪色,淡黄绿色
试题分析:SO2具有漂白性,能使品红溶液褪色;SO2具有还原性,能被酸性高锰酸钾溶液氧化褪色;SO2是酸性氧化物,溶于水生成亚硫酸,溶液显酸性,使紫色的石蕊试液变红色;氯气溶于水生成氯化氢和次氯酸,所以过量的氯气通到紫色石蕊溶液,溶液先变红色,后褪色,最终溶液为淡黄绿色。2的性质
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础性知识的巩固和训练,有利于培养学生灵活运用基础知识解决实际问题的能力,提高学生的应试能力和学习效率。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
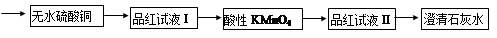
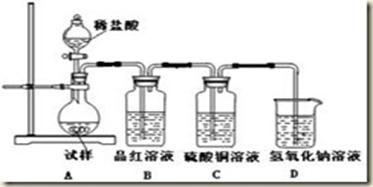
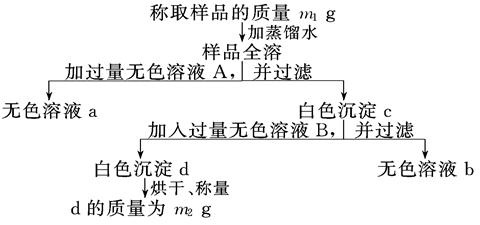

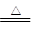 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O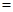 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O