题目内容
(6分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.。
(1) 在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
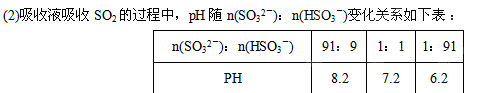
①由上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(1) 在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是

①由上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(6分)(1) SO2+2OH-= SO32-+H2O
(2)酸 HSO3-存在:HSO3-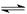 SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O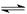 H2SO3+OH-,HSO3-的电离程度强于水解程度 ab
H2SO3+OH-,HSO3-的电离程度强于水解程度 ab
(2)酸 HSO3-存在:HSO3-
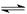 SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O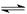 H2SO3+OH-,HSO3-的电离程度强于水解程度 ab
H2SO3+OH-,HSO3-的电离程度强于水解程度 ab试题分析:(1)氢氧化钠是强碱,SO2是酸性氧化物,能被氢氧化钠溶液吸收,反应的化学方程式是SO2+2OH-= SO32-+H2O。
(2)①在NaHSO3-液中存在:HSO3-
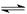 SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O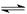 H2SO3+OH-。根据表中的数据可知,在SO32-和HSO3-的物质的量是1︰1的条件下,溶液是显酸性的,这说明HSO3-的电离程度大于SO32-和HSO3-的水解程度,因此溶液是显酸性的,所以NaHSO3溶液显酸性。
H2SO3+OH-。根据表中的数据可知,在SO32-和HSO3-的物质的量是1︰1的条件下,溶液是显酸性的,这说明HSO3-的电离程度大于SO32-和HSO3-的水解程度,因此溶液是显酸性的,所以NaHSO3溶液显酸性。②根据电荷守恒可知,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),所以如果溶液显中性,则c(H+) = c(OH-),c(Na+) = 2c(SO32-)+c(HSO3-),a正确,c不正确;由于不论是水解还是电离,其程度都是很弱的,所以b也是正确的,答案选ab。
点评:在判断离子浓度大小时,应该利用好电荷守、物料守恒和质子守恒等基本定律。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
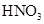 和
和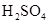 物质的量浓度分别为
物质的量浓度分别为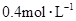 和
和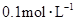 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中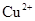 物质的量浓度(
物质的量浓度(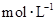 )为
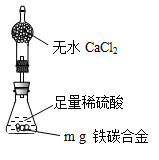
)为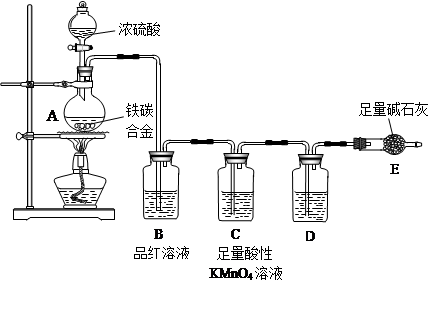
 C+NO2
C+NO2