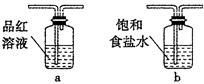
题目内容
为了证实木炭和浓H2SO4的反应产物,可用下列流程进行验证(箭头表示气体的流向)。
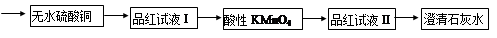
回答下列问题:
根据上述流程中什么现象证明产物是H2O、CO2、SO2:
; ; 。
(2)酸性KMnO4溶液的作用是 ,能否用溴水代替酸性高锰酸钾溶液? 。(填“能”或“不能”),请写出化学反应方程式 (若回答不能,则此空不用答题)
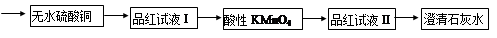
回答下列问题:
根据上述流程中什么现象证明产物是H2O、CO2、SO2:
; ; 。
(2)酸性KMnO4溶液的作用是 ,能否用溴水代替酸性高锰酸钾溶液? 。(填“能”或“不能”),请写出化学反应方程式 (若回答不能,则此空不用答题)
(1)无水硫酸铜变蓝,证明有H2O;品红试液I褪色,证明有SO2;
品红试液Ⅱ不褪色,澄清石灰水变浑浊,证明有CO2
(2)去除SO2;能; Br2+SO2+2H2O=2 HBr+H2SO4
品红试液Ⅱ不褪色,澄清石灰水变浑浊,证明有CO2
(2)去除SO2;能; Br2+SO2+2H2O=2 HBr+H2SO4
试题分析:(1)
 ;SO2可使品红褪色,所以品红试液I褪色,证明有SO2;当品红Ⅱ不褪色时则说明酸性KMnO4已经完全除去SO2气体。所以当石灰水变浑浊时可以说明CO2的存在。
;SO2可使品红褪色,所以品红试液I褪色,证明有SO2;当品红Ⅱ不褪色时则说明酸性KMnO4已经完全除去SO2气体。所以当石灰水变浑浊时可以说明CO2的存在。(2)SO2具有较强的还原性,可以被强氧化剂KMnO4氧化。因为溴水也具有强氧化性。所以也可以和SO2反应。Br2+SO2+2H2O=2 HBr+H2SO42的性质,以及CO2和SO2的鉴定问题。

练习册系列答案
相关题目
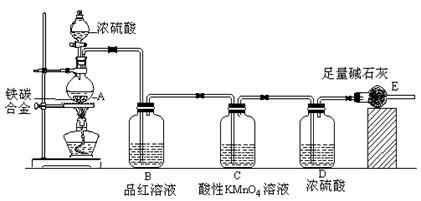
 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O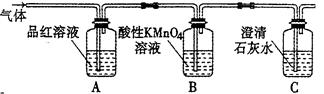
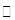 CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。