题目内容
有一纯净的亚硫酸钠晶体因部分被氧化而变质,为了测定样品中杂质的质量分数进行以下实验过程,按要求填写空格:
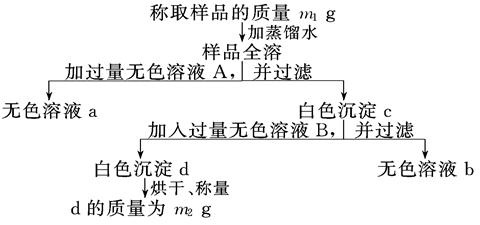
(1)向混合溶液中加入的无色溶液A是____________(填化学式),A必须过量的原因是
________________________________________________________________________.
(2)白色沉淀c中含有____________________(填化学式).
(3)无色溶液B通常是_____________(填试剂名称),加入后与c反应的离子方程式为
________________________________________________________________________.
(4)通过以上测定可得到样品中杂质的质量分数的计算式为_______________________.

(1)向混合溶液中加入的无色溶液A是____________(填化学式),A必须过量的原因是
________________________________________________________________________.
(2)白色沉淀c中含有____________________(填化学式).
(3)无色溶液B通常是_____________(填试剂名称),加入后与c反应的离子方程式为
________________________________________________________________________.
(4)通过以上测定可得到样品中杂质的质量分数的计算式为_______________________.
(8分)(1)BaCl2(1分)使SO32-、SO42-沉淀完全(1分)(2)BaSO4、BaSO3(1分)
(3)稀盐酸(1分)2H++BaSO3=H2O+SO2↑+Ba2+(2分)(4) (2分)
(2分)
(3)稀盐酸(1分)2H++BaSO3=H2O+SO2↑+Ba2+(2分)(4)
 (2分)
(2分)试题分析:(1)不论是亚硫酸钠,还是硫酸钠,都能和氯化钡溶液反应生成白色沉淀,据此可以检验和计算,所以A是氯化钡。氯化钡过量的目的是使使SO32-、SO42-沉淀完全。
(2)根据(1)中分析可知,白色沉淀c中含有BaSO4、BaSO3。
(3)要溶解亚硫酸钡,而又不能影响硫酸钡,则B应该是盐酸,不能用硝酸,因为硝酸具有氧化性,反应的方程式是2H++BaSO3=H2O+SO2↑+Ba2+。
(4)最终得到的白色沉淀d是硫酸钡,质量是m2g,则该原子守恒可知,样品中杂质的质量分数的计算式为
 。
。点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,难易适中,基础性强。在注重对学生基础知识巩固和训练的同时,侧重对学生实验能力的培养。有利于调动学生的学习兴趣,激发学生的学习积极性,也有利于培养学生的逻辑推理能力和规范严谨的实验设计能力和动手操作能力,提升学生的学科素养。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目