题目内容
【题目】某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
⑴写出上述反应的化学方程式______
⑵NaH2PO2为______![]() 填“正盐”或“酸式盐”
填“正盐”或“酸式盐”![]()
⑶已知NaH2PO2水溶液pH > 7,次磷酸的电离方程式为______;NaH2PO2水溶液pH > 7的原因:______。
⑷H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为______![]() 填化学式
填化学式![]() 。
。
【答案】P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑ 正盐 H3PO2 ![]() H2PO2- + H+ H2PO2- + H2O
H2PO2- + H+ H2PO2- + H2O![]() H3PO2+ OH- H3PO4
H3PO2+ OH- H3PO4
【解析】
⑴根据化合价升降分析得到。
⑵根据过量的热NaOH溶液反应,说明全部生成正盐。
⑶次磷酸为一元酸,H2PO2-会发生水解,水解显碱性。
⑷该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4:1,根据转移电子相得知。
⑴反应中磷元素化合价部分从0升高为+1价,部分降为-3价,根据氧化还原反应中得失电子数相等、原子守恒配平得到化学方程式为:P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑,故答案为:P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑。
⑵依据白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2 (次磷酸钠)可知H3PO2为一元酸,则NaH2PO2(次磷酸钠)为正盐;故答案为:正盐。
⑶依据⑵可知次磷酸为一元酸,NaH2PO2水溶液pH > 7,说明H2PO2-会发生水解,所以H3PO2是一元弱酸。次磷酸的电离方程式为:H3PO2 ![]() H2PO2- + H+,
H2PO2- + H+,![]() 水溶液 pH > 7的原因是弱酸阴离子水解,反应的离子方程式为:H2PO2- + H2O
水溶液 pH > 7的原因是弱酸阴离子水解,反应的离子方程式为:H2PO2- + H2O![]() H3PO2+ OH-,故答案为:H3PO2
H3PO2+ OH-,故答案为:H3PO2 ![]() H2PO2- + H+;H2PO2- + H2O
H2PO2- + H+;H2PO2- + H2O![]() H3PO2+ OH-。
H3PO2+ OH-。
⑷该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4:1,根据转移电子相等知,1 mol H3PO2失去4mol电子,所以P元素为+5价,则氧化产物是H3PO4,故答案为:H3PO4。

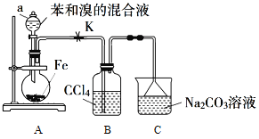
【题目】溴苯是一种重要化工原料,实验室制备溴苯的反应装置如图所示,有关数据如下:
苯 | 溴 | 溴苯 | |
相对分子质量 | 78 | 160 | 157 |
密度/gcm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)仪器a的名称为________
(2)在A装置中加入7.8 mL无水苯、适量液态溴和少量铁屑。实验时装置B中可能的现象为_____,装置C的作用是___________。
(3)反应充分后,取A装置中反应液,经过下列步骤分离提纯:
①向其中加入适量___(填试剂名称),然后____(填操作名称)除去未反应的铁屑;
②滤液依次用水、l0%的NaOH溶液、水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经以上分离操作后,粗溴苯中还含有一定量的杂质,要进一步提纯,下列仪器在该提纯步骤中没有使用到的是____(填入正确选项前的字母)。
A.  B.
B.  C.
C. ![]() D.
D.