题目内容
【题目】A、B、 C、D是原子序数依次增大的五种短周期主族元素。B、C、E最外层电子数之和为11;A 原子核外最外层电子数是次外层的2倍;C是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备D的单质;E单质是制备太阳能电池的重要材料。下列说法正确的是( )
A. 简单离子半径:B>C
B. 最高价氧化物对应水化物的酸性: A<E
C. 工业上不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 相同质量的C和D单质分别与足量稀盐酸反应,前者生成的氢气多
【答案】A
【解析】A、B、 C、D是原子序数依次增大的五种短周期主族元素。A 原子核外最外层电子数是次外层的2倍,A为C元素;C是同周期中原子半径最大的元素,C为Na元素;工业上一般通过电解氧化物的方法制备D的单质,D为Al元素;E单质是制备太阳能电池的重要材料,E为Si元素。B、C、E最外层电子数之和为11,则B最外层有7个电子,为F元素。A. 具有相同电子层结构的离子,核电荷数越大,离子半径越小,简单离子半径:B>C,故A正确;B. 元素的非金属性越强,最高价氧化物对应水化物的酸性越强,酸性A>E,故B错误;C. 工业上不用电解氯化物的方法制备单质铝是由于其氯化物是分子晶体,熔融状态不能导电,故C错误;D. 相同质量的钠和铝单质分别与足量稀盐酸反应,生成的氢气的物质的量之比为![]() :
:![]() =
=![]() ,钠生产的氢气少,故D错误;故选A。
,钠生产的氢气少,故D错误;故选A。

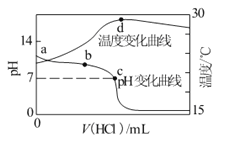
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和__________________、_________________。
(2)操作I为____________________操作Ⅱ为________________
(3)方案I中如何判别加入的氯化钡已经过量_____________在方案Ⅱ中滴定终点的判断方法是________________。
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为______________。(写成分数形式)有同学模仿方案I,提出方案Ⅲ:取25.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a. 方案I比方案Ⅲ的计算结果要低
b. 方案I比方案Ⅲ的计算结果要高
c. m1=m2 ,方案I和方案Ⅲ的结果一样
d. 方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a. 方案I中如果没有洗涤操作,实验结果将偏小
b. 方案I中如果没有操作Ⅱ,实验结果将偏大
c. 方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d. 方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大