题目内容
4. 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液.实验现象:
试管①中,加热一段时间后,可以看到试管内液体沸腾;
试管②有少量液体凝结,闻到汽油的气味;往液体滴加几滴高锰酸钾酸性溶液颜色褪去;
试管③中的有气泡放出;溴水颜色逐渐褪去.
根据实验现象,回答问题:
(1)装置A的作用是:防止试管③中液体倒吸回试管②中(或用作安全瓶).
(2)试管①中发生的主要反应有:
C17H36$→_{加热}^{催化剂}$C8H18+C9H18
十七烷 辛烷 壬烯
C8H18$→_{加热}^{催化剂}$C4H10+C4H8
辛烷 丁烷 丁烯
丁烷和丁烯还可进一步裂解,除得到甲烷和乙烯外,还可以得到另两种有机物,它们的结构式为:
 ;
;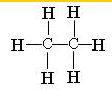 .
.(3)写出试管③中反应的一个化学方程式:
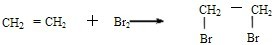 ,该反应的反应类型为加成反应.
,该反应的反应类型为加成反应.(4)试管②中的少量液体的组成是CD(填序号)
A.甲烷 B.乙烯 C.液态烷烃 D.液态烯烃.
分析 (1)CH2=CH-CH3和CH2=CH2能与溴水发生加成反应;
(2)丁烷分解的方程式为C4H10→CH4+CH2=CHCH3,C4H10→C2H6+CH2=CH2;
(3)试管③中CH2=CH-CH3和CH2=CH2能与溴水发生加成反应;
(4)石蜡在催化剂氧化铝存在下,加热可以裂化为短链的气态饱和烃和不饱和烃,还有液态的饱和烃和不饱和烃.
解答 解:(1)CH2=CH-CH3和CH2=CH2能与溴水发生加成反应,使气压降低,发生倒吸,装置A的作用是防止试管③中液体倒吸回试管②中,
故答案为:防止试管③中液体倒吸回试管②中(或用作安全瓶);
(2)丁烷的两种裂解方式为:C4H10→CH4+CH2=CHCH3,C4H10→C2H6+CH2=CH2,除得到甲烷和乙烯外,还可以得到另两种有机物为丙烯和乙烷,结构式分别为: 、
、 ,
,
故答案为: 、
、 ;
;
(3)CH2=CH-CH3和CH2=CH2能与溴水发生加成反应,如:乙烯与溴发生加成反应的反应方程式为: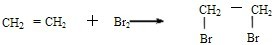 ,
,
故答案为: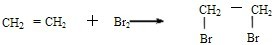 ;加成反应;
;加成反应;
(4)石蜡在催化剂氧化铝存在下,加热可以裂化为短链的气态饱和烃和不饱和烃,还有液态的饱和烃和不饱和烃,所以C、D正确,
故答案为:CD.
点评 本题考查了乙烯的制备及化学性质,题目难度中等,明确制备原理为解答关键,注意掌握常见有机物结构与性质,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 强电解质溶液不一定比弱电解质溶液的导电性强 | |
| C. | 盐酸、氢氧化钠、硫酸钡和氧化铝一定是强电解质 | |
| D. | 强、弱电解质的导电性由溶液中溶质的浓度决定 |
19.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
| A. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 | |
| B. | 0.1mol/L的盐酸和0.05mol/L的氢氧化钡溶液 | |
| C. | pH=3的醋酸和pH=11的氢氧化钠溶液 | |
| D. | pH=3的盐酸和pH=l1的氨水 |
16.能正确表示下列化学反应的离子方程式的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| B. | 饱和氢氧化钙溶液与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 在氢氧化钡溶液中加入少量小苏打:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |