题目内容
12.计算题(要写计算过程)已知反应:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O,现有7.4g Ca(OH)2与足量的NH4Cl充分反应.求
(1)生成的NH3在标准状况时的体积为多少?
(2)将所得NH3气体溶于100g水中,若所得氨水的密度为0.8g/mL,则该氨水的物质的量浓度为多少?(结果保留两位小数)
分析 (1)根据n=$\frac{m}{M}$计算n(Ca(OH)2),再根据方程式计算n(NH3),根据V=nVm计算V(NH3);
(2)根据m=nM计算m(NH3),溶液质量=水的质量+氨气质量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算.
解答 解:(1)n(Ca(OH)2)=$\frac{7.4g}{74g/mol}$=0.1mol,
Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O
1 2
0.1mol n(NH3)
所以1:0.1mol=2:n(NH3),解答 n(NH3)=0.2mol
V(NH3)=0.2mol×22.4L/mol=4.48L,
答:生成的NH3在标准状况时的体积为4.48L;
(2)由于n(NH3)=0.2mol,则m(NH3)=0.2mol×17g/mol=3.4g,m(溶液)=100g+3.4g=103.4g,则溶液体积V=$\frac{103.4g}{800g/L}$$\frac{103.4}{800}$L,溶液物质的量浓度为$\frac{0.2mol}{\frac{103.4}{800}L}$=1.55mol/L,
答:溶液物质的量浓度为1.55mol/L.
点评 本题考查化学方程式计算、物质的量浓度计算,(2)中关键是计算溶液体积,难度不大.

练习册系列答案
相关题目
3.能正确表示下列反应的离子方程式是( )
| A. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 向KHSO4溶液中加入Ba(OH)2溶液至恰好沉淀完全:Ba2++H++SO42-+OH-═BaSO4↓+H2O |
20.下列事实,不能用勒夏特列原理解释的是( )
| A. | 实验室常用排饱和食盐水的方法收集氯气 | |
| B. | 工业合成氨控制温度在较高温度(500℃)进行 | |
| C. | 在浓氨水中加入烧碱可用于实验室快速生氨 | |
| D. | 工业上将二氧化硫转化为三氧化硫常通入过量空气 |
7.下列说法正确的是( )
| A. | 试管、烧杯、量筒、坩埚等仪器都可以用于加热 | |
| B. | 加入稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| C. | 进入煤矿井时,用火把照明 | |
| D. | 为除去CO2中的CO得到纯净的CO2,可将混合气体在过量的O2燃烧即可 |
17.已知反应mX(g)+nY(g)═qZ(g)△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A. | 若再加入X,平衡向正反应方向移动,Z在平衡混合物中的体积分数一定增大 | |
| B. | X的正反应速率是Y的逆反应速率的m/n倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 通入稀有气体使压强增大,平衡将向正反应方向移动 |

 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液. ;
; .
. ,该反应的反应类型为加成反应.
,该反应的反应类型为加成反应.
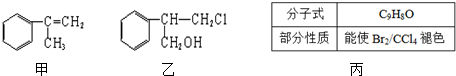

 +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$ (不需注明反应条件).
(不需注明反应条件).
 .
. 、
、 、
、 .
.