题目内容
【题目】在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是:____________。
(2)硅与铝同周期.地壳里硅铝的含量硅____________铝(填>,<或=)。工业上制备金属铝的化学方程式是: ____________,工业上制备硅的化学方程式有:
a.SiO2+2C![]() Si(粗)+2CO
Si(粗)+2CO
b.SiO2+3C![]() SiC +2CO(副反应),
SiC +2CO(副反应),
c.Si(粗)+ 2C12![]() SiCl4
SiCl4
d.SiC14 + 2H2![]() Si+4HC1,
Si+4HC1,
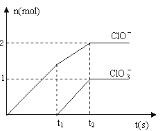
某同学将氧化还原反应、非氧化还原反应及四大基本反应绘制成上图,其中属于上图“2"区域的反应是____________ (填序号)。

(3)SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2OCaO6SiO2,钠长石(NaAlSi3O8)的氧化物形式____________,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同.由此可推知钙长石的化学式为____________。
(4)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A 份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是n(Si)____________和n(Mg)____________。
【答案】(1)铺上一层KClO3粉末,点燃插入的镁条;(2)>;Al2O3![]() 4 Al+3O2↑;b;
4 Al+3O2↑;b;
(3) Na2OAl2O36SiO2;CaAl2Si2O8; (4)0.4mol;0.6mol
【解析】
试题分析:(1)氧化铁和铝在高温下发生铝热反应生成氧化铝和铁,反应的化学方程式为Fe2O3+2Al![]() 2Fe+Al2O3,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应放出大量的热,镁为引燃剂,所以引发铝热反应的实验操作是加少量KClO3,插上镁条并将其点燃,故答案为:铺上一层KClO3粉末,点燃插入的镁条;
2Fe+Al2O3,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应放出大量的热,镁为引燃剂,所以引发铝热反应的实验操作是加少量KClO3,插上镁条并将其点燃,故答案为:铺上一层KClO3粉末,点燃插入的镁条;
(2)地壳中含量排在前五位的元素分别是:O、Si、Al、Fe、Ca,地壳里硅铝的含量硅大于铝;工业上通过电解氧化铝冶炼金属铝,反应的化学方程式为,Al2O3![]() 4 Al+3O2↑;图中“2"区域表示该反应属于氧化还原反应,但不属于四类基本反应,a.SiO2+2C
4 Al+3O2↑;图中“2"区域表示该反应属于氧化还原反应,但不属于四类基本反应,a.SiO2+2C![]() Si(粗)+2CO属于置换反应,是四类基本反应,错误;b.SiO2+3C
Si(粗)+2CO属于置换反应,是四类基本反应,错误;b.SiO2+3C![]() SiC +2CO(副反应),属于氧化还原反应,但不属于四类基本反应,正确;c.Si(粗)+ 2C12
SiC +2CO(副反应),属于氧化还原反应,但不属于四类基本反应,正确;c.Si(粗)+ 2C12![]() SiCl4,属于化合反应,是四类基本反应,错误;d.SiC14 + 2H2
SiCl4,属于化合反应,是四类基本反应,错误;d.SiC14 + 2H2![]() Si+4HC1,属于置换反应,是四类基本反应,错误;故选b;故答案为:>;Al2O3
Si+4HC1,属于置换反应,是四类基本反应,错误;故选b;故答案为:>;Al2O3![]() 4 Al+3O2↑;b;
4 Al+3O2↑;b;
(3)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMOnSiO2mH2O),钠长石(NaAlSi3O8)的碱性氧化物Na2O、两性氧化物Al2O3、酸性氧化物SiO2,因此钠长石的氧化物形式为:Na2OAl2O36SiO2;结合钠长石的化学式可知钙长石就是将钠长石的中钠更换为钙,以及化合物中化合价代数和等于0可得钙长石,其氧化物形式为:CaOAl2O32SiO2,化学式为CaAl2Si2O8,故答案为:>;Na2OAl2O36SiO2;CaAl2Si2O8;
(4)A份中Al、Si与氢氧化钠溶液反应,B份中Al、Mg与盐酸反应,A份和B份中Al反应放出的气体相等,因此两份气体差和质量差均来源于Mg、Si,Si、Mg与生成氢气的物质的量关系为:Si~2H2、Mg~H2,标准状况下2240mL气体的物质的量为![]() =0.1mol,设A份中含有的Si的物质的量为xmol,B份中含有Mg的物质的量为ymol,由质量差可得:①24y-28x=1.6
=0.1mol,设A份中含有的Si的物质的量为xmol,B份中含有Mg的物质的量为ymol,由质量差可得:①24y-28x=1.6
由气体相差0.1mol可得:②2x-y=0.1,
联立求得:x=0.2,y=0.3,则样品中Si和Mg的物质的量分别0.4mol、0.6mol,
故答案为:0.4mol;0.6mol

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案