题目内容
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_____________;
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_____________操作。
(3)浸出液“净化”过程中加入的主要物质为_____________,其作用是_______。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是_____________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为_____________。
【答案】ZnO 浸出 Zn粉 置换出Fe杂质 O2 2ZnS+4H++O2=2Zn2++2S↓+2H2O
【解析】
由流程图离子,硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用。
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO,故答案为:ZnO;
(2)焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作,故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而除去Fe,故答案为:Zn粉;置换出Fe杂质;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,产物为O2,故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,反应的化学方程式为2ZnS+4H++O2=2Zn2++2S↓+2H2O,故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
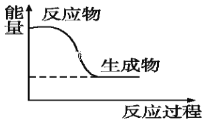
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。