题目内容
【题目】向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是
A.当0<b<a/3时:SO2+H2O+3ClO-=![]() +2HClO+Cl-
+2HClO+Cl-
B.当b=a时,SO2+H2O+ClO-==2H++Cl-+![]()
C.当a/3≤b≤a时,反应后溶液中H+的物质的量: 0<n(H+)≤2b mol
D.当0<b<a时,反应后溶液中ClO-、Cl-和![]() 物质的量之比为:(a-b)∶b∶b
物质的量之比为:(a-b)∶b∶b
【答案】D
【解析】
根据得失电子守恒可知如果bmol恰好被氧化为硫酸需要bmol次氯酸钠,生成bmol氯化钠,据此回答。
A.当0<b<a/3时次氯酸钠过量,过量的次氯酸钠结合氢离子转化为次氯酸,即SO2+H2O+3ClO-=SO42-+2HClO+Cl-,故A正确;
B.根据以上分析可知当b=a时,反应的离子方程式为SO2+H2O+ClO-=2H++Cl-+SO42-,故B正确;
C.当a/3=b时过量的次氯酸钠结合生成的氢离子转化为次氯酸,b=a时生成硫酸和氯化钠,氢离子的物质的量为2bmol,因此当a/3≤b≤a时,反应后溶液中H+的物质的量:0<n(H+)≤2bmol,故C正确;
D.当0<b<a时,次氯酸钠过量,SO2全部转化为bmol硫酸,根据得失电子守恒可知生成bmol氯离子,剩余的次氯酸钠是(a-b)mol,剩余的次氯酸钠结合氢离子转化为次氯酸,因此最终次氯酸钠的物质的量小于(a-b)mol,故D错误;
故答案选D。

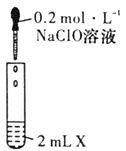
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
|
|
| 产生黄绿色气体 |
|
| 溶液变蓝 | |
|
| 溶液变红 | |
|
| 产生白色沉淀 | |
下列判断不正确的是![]()
![]()
A.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
B.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
C.实验![]() 中该条件下氧化性强弱
中该条件下氧化性强弱![]()
D.实验![]() 中
中![]() 与
与![]() 相互促进水解
相互促进水解