题目内容
【题目】科研人员设想用如图所示装置生产硫酸,下列说法正确的是( ) 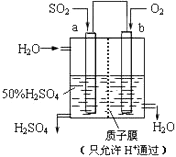
A.a为正极,b为负极
B.负极反应式为2H2O+SO2﹣2e﹣=SO42﹣+4H+
C.电子从b极向a极移动
D.生产过程中H+由b电极区通过质子膜向a电极区运动
【答案】B
【解析】解:A.该原电池中,二氧化硫失电子发生氧化反应生成硫酸,所以通入二氧化硫的电极是负极、通入氧气的电极是正极,所以a是负极、b是正极,故A错误;
B.负极上二氧化硫失电子发生氧化反应,电极反应式为SO2+2H2O﹣2e﹣=SO42﹣+4H+ , 故B正确;
C.电子从负极沿导线流向正极,a是负极、b是正极,所以电子从a极流向b极,故C错误;
D.溶液中阳离子向正极移动,所以H+向正极b电极区域运动,故D错误;
故选B.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目