��Ŀ����
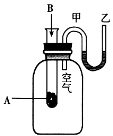
����Ŀ��I��Ϊ���о���ѧ��ӦA+B![]() C+D�������仯�����ijͬѧ�������ͼ��ʾװ�á�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ��������
C+D�������仯�����ijͬѧ�������ͼ��ʾװ�á�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ��������
�Իش�����������
��1���÷�ӦΪ_______��Ӧ(����ȡ������ȡ�)��
��2��A��B����������C��D��������_______(��ߡ��͡�)��
��3�������еĻ�ѧ��ͨ����ѧ��Ӧת����_______�ͷų�����
��4����Ӧ�ﻯѧ���������յ�����_______(��ߡ��͡�)�������ﻯѧ���γɷų���������
��5��д��һ���������������Ļ�ѧ����ʽ��_____________________��
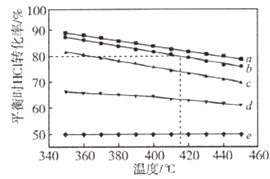
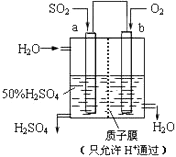
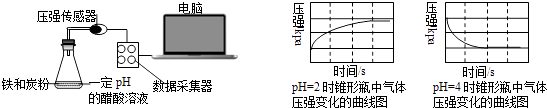
����ͬ���������ת���ķ�Ӧ���൱С������ת�����ʽ�������ʱ���ܲ���ȫ���ⶨ��Ӧ�Ⱥ����ѡ����ڿɸ��ݸ�˹����ġ����ܻ�ѧ������һ����ɻ�ּ�����ɣ�����ܹ��̵���ЧӦ����ͬ�ġ��۵������㷴Ӧ�ȡ�
��֪��
P4(���ף�s)+5O2(g)![]() P4O10(s) ��H=2983.2 kJ��mol1 ��
P4O10(s) ��H=2983.2 kJ��mol1 ��
P(���ף�s)+ ![]() O2(g)
O2(g)![]()
![]() P4O10(s) ��H=738.5 kJ��mol1 ��
P4O10(s) ��H=738.5 kJ��mol1 ��
�����ת��Ϊ�����Ȼ�ѧ����ʽΪ______________����ͬ״���£�����״̬�ϵ͵���_______�������ȶ��ԱȺ���_______(��ߡ��͡�)��
���𰸡�������1������ ��2����
��3������ ��4����
��5��2Al+6HCl ![]() 2AlCl3+3H2��
2AlCl3+3H2��
(��2Na+2H2O ![]() 2NaOH+H2����NaOH+HCl
2NaOH+H2����NaOH+HCl![]() NaCl+H2O�Ⱥ����𰸾���)
NaCl+H2O�Ⱥ����𰸾���)
����P4(���ף�s) ![]() 4P(���ף�s) ��H=29.2 kJ mol1 ���� ��
4P(���ף�s) ��H=29.2 kJ mol1 ���� ��
��������������1��U�ι��м״�Һ���½��Ҵ�Һ��������˵���÷�Ӧ���ȣ��¶����ߣ�ƿ�ڵ�ѹǿ����
��2�����ȷ�Ӧ����Ӧ��������������������������������A��B ����������C��D���������ߡ�
��3���¶����ߣ�˵�������еĻ�ѧ��ͨ����ѧ��Ӧת���������ͷų�����
��4����Ӧ��=��Ӧ����ܼ�����������ܼ��ܣ��÷�Ӧ���ȣ�˵����Ӧ����ܼ��ܵ�����������ܼ��ܡ�
��5�����ȷ�Ӧ��������ȼ�շ�Ӧ�����ý�������ķ�Ӧ���кͷ�Ӧ�ȣ���һ�����ɡ�
�������ݸ�˹���ɿ�֪������ת��Ϊ�����Ȼ�ѧ����ʽ=��4��������P4 (���ף�s ) ![]() 4P (���ף�s ) ��H= (2983.2 kJ mol1) 4 ��(738.5 kJ mol1)=29.2 kJmol1���÷�Ӧ�Ƿ��ȷ�Ӧ��˵�������������ڰ��ף��������ȶ��ԱȺ��͡�
4P (���ף�s ) ��H= (2983.2 kJ mol1) 4 ��(738.5 kJ mol1)=29.2 kJmol1���÷�Ӧ�Ƿ��ȷ�Ӧ��˵�������������ڰ��ף��������ȶ��ԱȺ��͡�

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�