题目内容
【题目】某同学组装了如右图所示的电化学装置,电极Ⅰ为 Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是
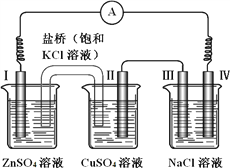
A. 电流方向:电极Ⅳ → ○ → 电极Ⅰ
B. 盐桥中的K+会移向ZnSO4溶液
C. III处得到气体2.24L,电极II上析出6.4g固体
D. NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠
【答案】A
【解析】试题分析:A、装置中左边两个烧杯构成为原电池,锌做原电池的负极,铜为原电池的正极,电流从铜电离流出经过电流表流向锌,所以选A;B、盐桥中钾离子向阴极负极移动,即流向硫酸铜溶液,不选B;C、第三个烧杯是电解氯化钠溶液,电极Ⅲ为电解池的阳极,产生氯气,当有2.24升氯气产生时有2.24/22.4摩尔氯气,有0.2摩尔电子转移,所以电极II上析出0.1摩尔铜,即析出6.4g固体,选C;D、氯化钠溶液中电解得到氯气和氢气和氢氧化钠,没有得到金属钠,不选D。

【题目】一定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,容器甲中的逆反应速率比容器乙中的小
C. 达平衡时,转化率:α(CO2 ,甲)+α(C2H5OH ,丙)>1
D. 达平衡时,甲、乙容器内:2c(CO2 ,甲)<c(CO2 ,乙)
【题目】下列实验操作、现象以及原因完全对应的是
实验操作 | 实验现象 | 原因 | |
A | 室温下,向浓度均为0.01mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)< Ksp(CaSO4) |
B | 将水蒸气通过灼热的铁粉 | 铁粉变为红色 | 铁可以与水在高温下发生反应 |
C | 向淀粉水解的产物中加入新制的银氨溶液 | 没有出现银镜现象 | 催化剂与新制的银氨溶液发生了反应 |
D | 相同温度下,将相同大小钠块分别加到水、醋酸、乙醇中 | 生成氢气的速率:醋酸>水>乙醇 | 三种电解质电离H+能力:醋酸>水>乙醇 |
A. A B. B C. C D. D

