题目内容
【题目】联合国宣布2019年为“国际化学元素周期表年”。短周期主族元素A、B、C、D、E的原子序数依次增大。A原子的最外层电子数是其内层电子数的2倍,B的单质是空气的最主要成分,C的单质在某些浓酸溶液中能发生钝化,D和A在同一主族,E的其中一种氧化物是造成酸雨的主要物质之一。请回答下列问题:
(1)A元素的名称为_________;元素E在周期表中的位置是________。
(2)A、B、D的原子半径的大小顺序是_________(用元素符号表示)。A和D的简单气态氢化物中稳定性较强的是___________(用化学式表示)。
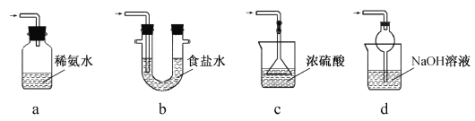
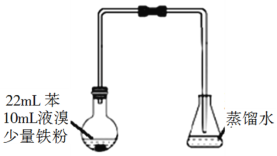
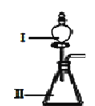
(3)B和D最高价氧化物对应的水化物中,酸性较强的是___________。若用如图中装置验证这两种酸的酸性强弱,则在装置Ⅱ中加入的试剂分别为__________,观察到的实验现象是__________。
(4)AE2常温下呈液态,则AE2的化学键类型是_______。已知AE2在氧气中完全燃烧,生成AO2和EO2,若 0.1 mol AE2在 1 mol O2中完全燃烧,所得混合气体在标准状况下的体积为________L。
(5)B的最高价氧化物对应的水化物的稀溶液与SO2反应的离子方程式为________
【答案】碳 第三周期第VIA族 Si>C>N CH4 HNO3 Na2SiO3 Ⅱ中产生白色沉淀 共价键 22.4L 3SO2 + 2NO3- + 2H2O = 3SO42- + 2NO↑ + 4H+
【解析】
A原子的最外层电子数是其内层电子数的2倍,A的内层为K层,K层填满有2个电子,则A的最外层有4个电子,A为C;B的单质是空气的最主要成分,则B为N;C的单质在某些浓酸溶液中能发生钝化,在短周期中Al遇浓硫酸、浓硝酸钝化,则C为Al;D和A在同一主族,D为Si;E的其中一种氧化物是造成酸雨的主要物质之一,结合原子序数,E为S。则A、B、C、D、E分别为C、N、Al、Si、S。
(1)A为C元素,其名称为碳;E为S元素,在周期表的位置是第三周期第ⅥA族;
(2)同周期元素原子从左到右依次减小,C>N;同主族元素原子从上到下依次增大,则Si>C;则A、B、D原子半径的大小半径是Si>C>N;同主族元素从上到下,非金属性减弱,非金属性越强,其气态氢化物的稳定性越强,则CH4的稳定性强;
(3)同主族元素非金属性从上到下依次减弱,同周期元素从左到右依次增强,可知非金属性N(B)>C>Si(D),非金属性越强,其最高价氧化物的水化物的酸性越强,则酸性较强的是HNO3;要证明HNO3的酸性强于H2SiO3,利用强酸制弱酸的方法,分液漏斗中盛装硝酸,锥形瓶中盛装Na2SiO3溶液,发生生成硅酸沉淀;可看到Ⅱ中产生白色沉淀;
(4)AE2为CS2,C达到稳定结构需要得到4个电子,S达到稳定结构需要得到2个电子,因此C和S通过共用达到稳定结构,CS2中含有共价键;CS2燃烧的化学方程式为CS2+3O2=CO2+2SO2,CS2是液体,该反应前后气体体积不变,因此0.1molCS2在1molO2中完全燃烧,所得混合气体的物质的量为1mol,其在标准状况下的体积为22.4L;
(5)B的最高价氧化物对应的水化物的稀溶液为稀硝酸;SO2具有还原性,HNO3具有氧化性,发生氧化还原反应,离子方程式为3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+。