题目内容
【题目】某研究小组拟合成医药中间体X和Y。
已知:①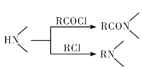 ;
;
②![]() ;
;
③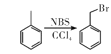 。
。
(1)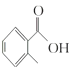 的名称是__________
的名称是__________
(2)G→X的反应类型是_____________。
(3)化合物B的结构简式为_____________。
(4)下列说法不正确的是__________(填字母代号)
A. 化合物A能使酸性KMnO4溶液褪色
B.化合物C能发生加成、取代、消去反应
C.化合物D能与稀盐酸反应
D.X的分子式是C15H16N2O5
(5)写出D+F→G的化学方程式:____________________
(6)写出化合物A(C8H7NO4)同时符合下列条件的两种同分异构体的结构简式_______。
①分子是苯的二取代物,1H—NMR谱表明分子中有4种化学环境不同的氧原子;
②分子中存在硝基和![]() 结构。
结构。
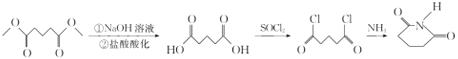
(7)参照以上合成路线设计E→![]() 的合成路线(用流程图表示,无机试剂任选)。
的合成路线(用流程图表示,无机试剂任选)。
____________________________________________。
【答案】邻甲基苯甲酸 还原反应 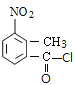 BD
BD 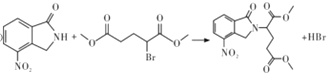
![]() 、
、![]() 、
、![]() 、
、![]()
【解析】
由![]() 、A的分子式,纵观整个过程,结合X的结构,可知
、A的分子式,纵观整个过程,结合X的结构,可知![]() 发生甲基邻位硝化反应生成A为
发生甲基邻位硝化反应生成A为 ,对比各物质的分子,结合反应条件与给予的反应信息,可知A中羧基上羟基被氯原子取代生成B,B中甲基上H原子被溴原子取代生成C,C中氯原子、溴原子被-NH-取代生成D,故B为
,对比各物质的分子,结合反应条件与给予的反应信息,可知A中羧基上羟基被氯原子取代生成B,B中甲基上H原子被溴原子取代生成C,C中氯原子、溴原子被-NH-取代生成D,故B为 、C为
、C为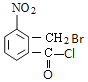 、D为
、D为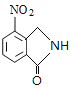 。由X的结构,逆推可知G为
。由X的结构,逆推可知G为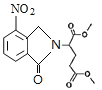 ,结合F、E的分子式,可推知F为CH3OOCCHBrCH2CH2COOCH3、E为CH3OOCCH2CH2CH2COOCH3。
,结合F、E的分子式,可推知F为CH3OOCCHBrCH2CH2COOCH3、E为CH3OOCCH2CH2CH2COOCH3。
根据上述分析可知:A为 ;B为
;B为 ;C为
;C为 ;D为
;D为 ;E为CH3OOCCH2CH2CH2COOCH3;F为CH3OOCCHBrCH2CH2COOCH3;G为
;E为CH3OOCCH2CH2CH2COOCH3;F为CH3OOCCHBrCH2CH2COOCH3;G为 。
。
(1)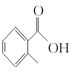 的甲基在苯环羧基的邻位C原子上,因此其名称是邻甲基苯甲酸;
的甲基在苯环羧基的邻位C原子上,因此其名称是邻甲基苯甲酸;
(2)G变X是-NO2变为-NH2,发生的是还原反应;
(3)化合物B的结构简式为 ;
;
(4)A.化合物A的苯环上有甲基,能酸性KMnO4溶液氧化,因而可以使酸性KMnO4溶液褪色,A正确;
B.化合物C结构简式是 ,含苯环与羰基能发生加成反应,有Br原子可以发生取代反应;由于Br原子连接的C原子直接连接在苯环上,因此不能发生消去反应,B错误;
,含苯环与羰基能发生加成反应,有Br原子可以发生取代反应;由于Br原子连接的C原子直接连接在苯环上,因此不能发生消去反应,B错误;
C.化合物D 含有亚氨基,能与稀盐酸反应,C正确;
含有亚氨基,能与稀盐酸反应,C正确;
D.根据物质的结构简式可知X的分子式是C15H18N2O5,D错误;
故合理选项是BD;
(5)D+F→G的化学方程式为: ;
;
(6)化合物A(C8H7NO4)的同分异构体同时符合下列条件:①分子是苯的二取代物,1H-NHR谱表明分子中有4种化学环境不同的氢原子,存在对称结构;②分子中存在硝基和酯基结构,2个取代基可能结构为:-NO2与-CH2OOCH、-NO2与-CH2COOH、-COOH与-CH2NO2、-OOCH与-CH2NO2,同分异构体可能结构简式为![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(7)由E(CH3OOCCH2CH2CH2COOCH3)先在NaOH溶液中发生水解反应,然后酸化可得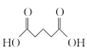 ,该物质与SOCl2发生反应产生
,该物质与SOCl2发生反应产生![]() ,
,![]() 与NH3发生反应得到目标产物
与NH3发生反应得到目标产物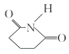 ,故由E合成
,故由E合成 的路线为:
的路线为: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
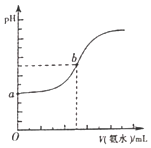
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。