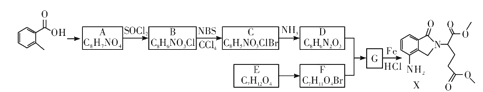
题目内容
【题目】(1)碳能与氢、氮、氧三种元素组成化合物CO(NH2)2,该物质易溶于水的主要原因是____。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是________。
②MgCO3分解温度比CaCO3低的原因是___________。
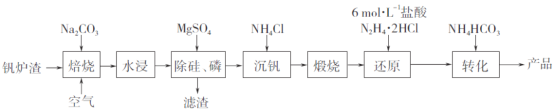
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:____________。
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有![]() 键的数目为________。
键的数目为________。
(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(![]() ),C为(
),C为(![]() );则D原子的坐标参数为________。
);则D原子的坐标参数为________。
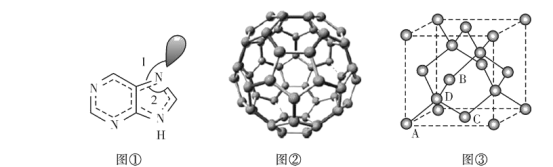
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图①所示,其中(〇为Se,●为Mn),则Se的配位数为____,Mn和Se的摩尔质量分别为M1 g/mol、M2 g/mol,该晶体的密度为![]() g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
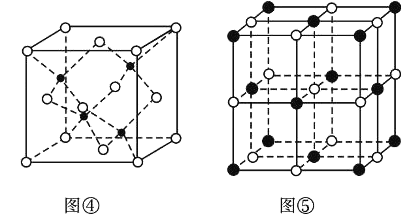
(7)KI的晶胞结构如图⑤所示,已知其晶体的密度为![]() g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
【答案】CO(NH2)2分子与水分子之间能形成氢键 平面三角形 氧化镁晶格能比氧化钙大,使得Mg2+比Ca2+更容易结合CO32-在的氧离子 孤电子对与键合电子对之间的斥力大于键合电子对之间的斥力,斥力大,键角大 90 (![]() ) 4
) 4 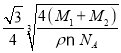 ×107
×107  ×100%
×100%
【解析】
(1)化合物CO(NH2)2分子与水分子之间存在氢键,增加了分子之间的吸引力;
(2)①用价层电子对数分析CO32-的立体构型;
②用晶格能大小分析解答;
(3)根据VSEPR理论,孤电子对对键合电子对之间的斥力大于键合电子对对键合电子对之间的斥力,导致键合电子对对键合电子对之间的夹角减少;
(4)每个碳原子形成3个σ键,每σ键为2个碳原子共有,则平均每个碳原子形成1.5个σ键;
(5)D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,过面心B、C及上底面面心原子的平面且平行侧面将晶胞2等分,同理过D原子的且平衡侧面的平面将半个晶胞2等份,可知D到各坐标平面的距离均为晶胞棱长![]() ;
;
(6)在晶体中每个Se原子连接4个Mn原子、每个Mn原子连接4个Se原子;用均摊方法计算晶胞中Se、Mn原子个数,利用密度ρ=![]() 计算晶胞参数,然后根据距离最近的Se原子和Mn原子的距离为晶胞体长的
计算晶胞参数,然后根据距离最近的Se原子和Mn原子的距离为晶胞体长的![]() 计算距离最近的Se原子和Mn原子的距离;
计算距离最近的Se原子和Mn原子的距离;
(7)根据立体几何知识分析,晶胞边长根据密度和摩尔质量计算,据此计算。
(1)化合物CO(NH2)2分子与水分子之间存在氢键。增加了分子之间的吸引力,使尿素容易溶于水中;
(2)①CO32-的价层电子对数为3+![]() =3,无孤对电子,所以CO32-的立体构型为平面三角形;
=3,无孤对电子,所以CO32-的立体构型为平面三角形;
②Mg、Ca是同一主族的元素,MgCO3分解温度比CaCO3低的原因是由于氧化镁晶格能比氧化钙大,使得Mg2+比Ca2+更容易结合CO32-在的氧离子;
(3)根据VSEPR理论,孤电子对对键合电子对之间的斥力大于键合电子对对键合电子对之间的斥力,导致键合电子对对键合电子对之间的夹角减少,所以嘌呤中轨道之间的夹角∠1比∠2大;
(4)每个碳原子形成3个σ键,每σ键为2个碳原子共有,则平均每个碳原子形成1.5个σ键,则C60分子中有化学键σ键数目为60×1.5=90;
(5)D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,过面心B、C及上底面面心原子的平面且平行侧面将晶胞2等分,同理过D原子的且平衡侧面的平面将半个晶胞2等份,可知D到各坐标平面的距离均为晶胞棱长![]() ;
;
(6)在晶体中每个Se原子连接4个Mn原子、每个Mn原子连接4个Se原子,所以Se原子的配位数是4;在一个晶胞中含有Se的原子个数为:![]() ×8+
×8+![]() ×6=4;含有的Mn原子数为4,晶胞密度为ρg/cm3,晶胞参数L=
×6=4;含有的Mn原子数为4,晶胞密度为ρg/cm3,晶胞参数L=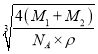 cm,晶胞体对角线长度为
cm,晶胞体对角线长度为![]() L=
L=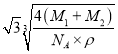 cm,由于距离最近的Se原子和Mn原子的距离为晶胞体长的
cm,由于距离最近的Se原子和Mn原子的距离为晶胞体长的![]() ,因此距离最近的Se原子和Mn原子的距离为
,因此距离最近的Se原子和Mn原子的距离为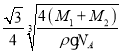 ×107nm;
×107nm;
(7)一个晶胞中,含有4个KI,所以一个晶胞中,V球=4×![]() π(
π(![]() +
+![]() )=
)=![]() π(
π(![]() +
+![]() ),KI晶体的密度为ρg/cm3,K和I的摩尔质量分别为MK g/mol和MI g/mol,则ρ=
),KI晶体的密度为ρg/cm3,K和I的摩尔质量分别为MK g/mol和MI g/mol,则ρ=![]() ,a3=
,a3=![]() ×1030,所以KI晶胞中原子的体积占晶胞体积的百分率为
×1030,所以KI晶胞中原子的体积占晶胞体积的百分率为![]() ×100%=
×100%=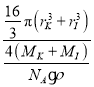 ×10-30×100%=
×10-30×100%=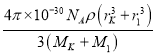 ×100%。
×100%。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案