题目内容
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.煤炭中起作用的主要元素是碳
B.该冶炼锌的方法属于热还原法
C.倭铅是指金属锌和铅的混合物
D.冶炼Zn的反应方程式为ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
【答案】C
【解析】
A.反应中C作还原剂,则煤炭中起作用的主要成分是C,故A正确;
B.依据方程式可知ZnCO3+2C![]() Zn+3CO↑,该反应是利用碳还原碳酸锌生成锌单质,属于热还原法,故B正确;
Zn+3CO↑,该反应是利用碳还原碳酸锌生成锌单质,属于热还原法,故B正确;
C.由题意可知,倭铅是指金属锌,不是混合物,故C错误;
D.碳酸锌与碳在高温下反应生成锌和一氧化碳,化学方程式:ZnCO3+2C![]() Zn+3CO↑,故D正确;
Zn+3CO↑,故D正确;
故选:C。

 走进文言文系列答案
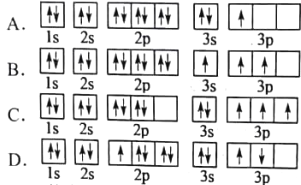
走进文言文系列答案【题目】X、Y、Z、W是短周期中的四种常见元素,其相关信息如表:
元素 | 相关信息 |
X | X最外层电子数是次外层电子数的3倍 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
Z | Z和Y同周期,Z的非金属性大于Y |
W | W的一种核素的质量数为23,中子数为12 |
(1)Y位于元素周期表第________周期________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是________(填化学式)。
(2)Z的简单离子的电子式为________。
(3)W可以与X形成两种化合物,写出这两种化合物的电子式:__________________、____________________。
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,如何处理这些气体,对保护大气环境意义重大,回答下列问题:
(1)已知:2NO2(g) ![]() 2NO(g)+O2(g) ΔH1=+115.2 kJ·mol-1;
2NO(g)+O2(g) ΔH1=+115.2 kJ·mol-1;
2O3(g) ![]() 3O2(g) ΔH2=-286.6 kJ·mol-1。
3O2(g) ΔH2=-286.6 kJ·mol-1。
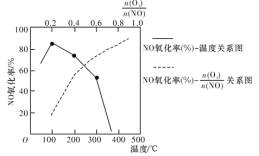
写出臭氧与NO作用产生NO2和O2的热化学方程式:___________。恒容密闭体系中NO氧化率随![]() 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随![]() 值增大而增大的主要原因是________________________。
值增大而增大的主要原因是________________________。
(2)实验测得反应2NO(g)+O2(g) ![]() 2NO2(g) △H<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
2NO2(g) △H<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
①温度为T1时,在1L的恒容密闭容器中,投入0.6 molNO和0.3 molO2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_______ T2 (填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO![]() N2O2 快速平衡 第二步:N2O2 +O2
N2O2 快速平衡 第二步:N2O2 +O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)
下列叙述正确的是______
A.同一温度下,平衡时第一步反应的![]() 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) ![]() 4CO2(g)+N2(g) △H<0
4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2 molCO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
①在此温度下,反应的平衡常数Kp=_________kPa-1(Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”);
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?_______(填“增大”、“减小”或“不变”),原因是_____________________。