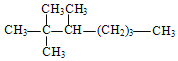题目内容
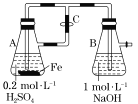
【题目】有A、B、C、D四种金属片,进行如下实验:①A、B用导线连接后浸入稀H2SO4中,电流由B ![]() 导线
导线 ![]() A;②C、D用导线相连后,同时伸入稀H2SO4 溶液中,C极为负极;③A、C相连后同时浸入稀H2SO4 中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4 中,D极发生氧化反应;试判断四种金属的活动顺序是( )
A;②C、D用导线相连后,同时伸入稀H2SO4 溶液中,C极为负极;③A、C相连后同时浸入稀H2SO4 中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4 中,D极发生氧化反应;试判断四种金属的活动顺序是( )
A.A>C>D>BB.A>B>C>DC.B>A>C>DD.B>D>C>A
【答案】A
【解析】
①A、B用导线连接后浸入稀H2SO4 中,电流由B ![]() 导线
导线 ![]() A,A为负极,B为正极,金属性A>B
A,A为负极,B为正极,金属性A>B
②C、D用导线相连后,同时伸入稀H2SO4 溶液中,C极为负极,D极为正极,则金属性C>D;
③A、C相连后同时浸入稀H2SO4 中,C极产生大量气泡,C为正极,A为负极,则金属性A>C;
④B、D相连后同时浸入稀H2SO4 中,D极发生氧化反应,D为负极,B为正极,则金属性D>B;
综上金属性:A>C>D>B;
答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目